| |
Grande Boloque, Rocío*
Apoita Sanz, María*
Vallina Fernández-Kelly, Carmen**
Cecilia Melero Alarcón***
Montañés de la Fuente, Alba****
Hernández Vallejo, Gonzalo****** Graduada en Odontología, Universidad San Pablo CEU. Especialista en Medicina Oral, Facultad de Odontología. UCM.
** Graduada en Odontología, Universidad de Oviedo. Especialista en Medicina Oral, Facultad de Odontología. Universidad Complutense, Madrid (UCM).
*** Graduada en Odontología. Universidad San Pablo CEU. Especialista en Medicina Oral (UCM). Máster en Cirugía bucal e implantología. UCM.
**** Graduada en Odontología, Universidad Complutense, Madrid. Profesora colaboradora del Título Especialista en Medicina Oral, Facultad de Odontología. UCM.
***** Catedrático de Medicina Bucal. Director del Departamento III (Medicina y Cirugía Bucofacial). Director del Título de Especialista en Medicina Oral. Facultad de Odontología, UCM.
Correspondencia:
Rocío Grande Boloque
Facultad de Odontología, UCM
Plaza Ramón y Cajal, s/n, 28040, Madrid
r.grandeboloque@gmail.com
Tel. 647592284
RESUMEN
Introducción: La OMS define cáncer como el término genérico que designa un amplio grupo de enfermedades que pueden afectar a cualquier parte del organismo, con características específicas como la rápida multiplicación celular y la diseminación a distancia. Cualquier cáncer de órganos sólidos, así como leucemias y mielomas son susceptibles de tratamiento quirúrgico, de radioterapia y quimioterápico. Este último da lugar a un amplio abanico de lesiones en la cavidad oral, que implican una serie de medidas preventivas y consideraciones odontológicas.
Objetivo: Valorar las lesiones orales más frecuentes en pacientes tratados con quimioterapia y determinar los protocolos odontológicos a seguir en este tipo de pacientes.
Material y métodos: Se realizó una búsqueda bibliográfica en la base de datos PUBMED/MEDLINE con los términos "oral manifestations", "oral management" y "chemotherapy"
Resultados: El paciente sometido a quimioterapia puede sufrir una serie de reacciones adversas que han de prevenirse antes, durante y tras el tratamiento. Además de las manifestaciones locales como mucositis, son de especial interés los cambios hematológicos y el tratamiento con fármacos antiangiogénicos como bifosfonatos o inmunoterápicos, ya que condicionan el tratamiento odontológico, en ocasiones limitándolo.
Conclusiones: El conocimiento, por parte del odontólogo y del paciente, de las repercusiones del tratamiento oncológico en la cavidad oral es imprescindible para minimizar los riesgos asociados, así como la colaboración interdisciplinar con el médico oncólogo.
ABSTRACT
Introduction: The WHO defines cancer as the generic term that designates a wide group of diseases that can affect any part of the organism, with specific characteristics such as rapid cell multiplication and distance dissemination. Any cancer of solid organs, as well as leukemias and myelomas are susceptible to surgical treatment, radiotherapy and chemotherapy. The latter leads to a wide range of lesions in the oral cavity, which imply a series of preventive measures and dental considerations.
Objective: To evaluate the most frequent oral lesions in patients treated with chemotherapy and determine the dental protocols to follow in this type of patients. Material and methods: A literature search was performed in the PUBMED / MEDLINE database with the terms "oral manifestations", "oral management" and "chemotherapy" Results: The patient undergoing chemotherapy can suffer a series of adverse reactions that must be prevented before, during and after treatment. In addition to local manifestations such as mucositis, hematological changes and treatment with antiangiogenic drugs such as bisphosphonates or immunotherapeutic drugs are of special interest, since they condition the dental treatment, sometimes limiting it. Conclusions: The knowledge, on the part of the dentist and the patient, of the repercussions of the oncological treatment in the oral cavity is essential to minimize the associated risks, as well as the interdisciplinary collaboration with the oncologist.
INTRODUCCIÓN La Organización Mundial de la Salud (OMS) define cáncer como término genérico que designa un amplio grupo de enfermedades que pueden afectar a cualquier parte del organismo; también denominados ‘tumores malignos' o ‘neoplasias malignas'. Como principal característica del cáncer destaca la multiplicación rápida de células anormales, que se extienden más allá de sus límites habituales. Esta replicación descontrolada puede provocar la invasión de partes adyacentes del cuerpo o propagarse a otros órganos, proceso que se denomina ‘metástasis'. Las metástasis son la principal causa de muerte por cáncer. 1 En el año 2017 salieron a la luz los datos de los proyectos EUCAN y GLOBOCAN, realizados por la OMS en 20121. La incidencia del cáncer fue de aproximadamente de 14 millones de casos nuevos de cáncer en todo el mundo ese año, siendo mayor en Asia, seguido de Europa, América del Norte, América del Sur, África y por último Oceanía. Los tumores diagnosticados han experimentado un crecimiento constante por el aumento poblacional, las técnicas de detección precoz y el aumento de esperanza de vida.
Los últimos datos referentes al cáncer en España son del 2015, publicados por la Red Española de Registros de Cáncer (REDECAN)2, Estos datos indican que el número total de nuevos casos de cáncer en España en 2015 fueron de 247.771 (148.827 en varones y 98.944 en mujeres).
De acuerdo con los datos de la REDECAN2, en el año 2015, una de cada tres muertes en varones y una de cada cinco en mujeres en España, se debieron a tumores malignos: más de una de cada 4 muertes en España se debieron a algún cáncer.
Debido a las actividades preventivas, las campañas de diagnóstico precoz y los avances terapéuticos, la mortalidad por tumores, entre 2003 y 2012, se redujo en España en un 1,32%, según el Instituto Nacional de Epidemiología (INE)2. En cualquier caso, uno de los aspectos más importantes a tener en cuenta dado que podemos incidir sobre ello, es que de acuerdo con los datos publicados por la OMS en su Informe Mundial del Cáncer 20142, alrededor de 1/3 de las muertes por cáncer son debidas a causas evitables, incluyendo el tabaco (responsable de hasta un 33% de los tumores a nivel global), las infecciones (responsables de un 18% de los tumores fundamentalmente en los países en vías de desarrollo) y el alcohol (responsable de hasta un 12% de los tumores en el mundo) como factores de riesgo más importantes. 2 El tumor maligno más frecuente de la cavidad oral es el carcinoma oral de células escamosas (COCE), generalmente originado por la mutación de la célula a partir de la que se desarrolla, el queratinocito. Normalmente es la mutación de algún gen del ADN la que propicia el crecimiento indiscriminado de estas células malignas. Mecanismos de reparación defectuosos, así como supresión de determinados genes supresores del cáncer son los principales mecanismos etiopatogénicos de la enfermedad.
Estos mecanismos etiopatogénicos se desarrollan a raíz de determinados factores de riesgo, como el tabaco, el alcohol o infecciones víricas como el virus del papiloma humano (VPH), en especial las cepas 16 y 18, o el virus de Epstein-Barr. 3
La exposición al tabaco se traduce en la desregulación de varias vías metabólicas: afecta a los receptores de las células del sistema inmune, suprime las funciones de las células endoteliales, linfocitos y macrófagos, así como la formación de errores en el ADN. Con ello se facilita en células con ADN afectado un proceso de autofagia que permitirá a la célula sobrevivir a procesos regulatorios homeostáticos y seguir adelante con la carcinogénesis. 4
Se ha demostrado que los efectos nocivos del tabaco en el papel del COCE es dosis-dependiente, y no tiene diferencias significativas en cuanto a la génesis del cáncer si el tabaco es fumado o mascado. 3
Otro factor de riesgo es la nuez de areca, prevalente sobre todo en países del sudeste asiático, ya que inhibe la acción de genes supresores de tumores como el p53 o el p14, p15, p16. 5
Si mencionamos el papel del alcohol en el proceso carcinogénico, el alcohol etílico afecta en la carcinogénesis por la liberación de acetaldehído. Además, favorece la permeabilidad de la mucosa oral. 4 El término de cáncer oral engloba los conceptos de cáncer de labio, cavidad oral y faringe, que en 2012 han sido responsables de una incidencia de 529.500 casos en 2012 y una mortalidad de 292.300 en ese mismo año. Los factores de riesgo en países desarrollados son el tabaco y el alcohol, mientras que en países subdesarrollados lo es la nuez de areca. Además de los factores de riesgo mencionados, también se ha relacionado la comida nitrogenada, radiación ultravioleta y déficits nutricionales. 6
En la actualidad, los pacientes con antecedente de cáncer son cada vez mayores, lo que genera para el odontólogo una serie de pautas que conocer y seguir en el tratamiento a estos pacientes. El tratamiento del cáncer de cabeza y cuello, según su estadio y su localización, suele ser la radioterapia, quimioterapia, tratamiento quirúrgico y la inmunoterapia principalmente. 7 Existen otros tipos de tumores no orales que afectan el sistema inmune, como las neoplasias hematológicas, que tienen especial interés en la consulta odontológica. Las que más afectan la cavidad oral son la leucemia, el linfoma y el mieloma8. La leucemia en muchos casos tiene un origen desconocido, y provoca alteraciones tanto en la médula ósea como en la sangre periférica, así como en otros órganos y tejidos. Se caracteriza, al realizar un estudio anatomopatológico, por la inmadurez, atipia y falta de diferenciación de madurez celular, sobre todo en las formas agudas más que en las crónicas. Las más comunes son las formas agudas linfoblásticas y mieloides, seguidas de las crónicas.8, 9 Aproximadamente un 25% de los pacientes con leucemia sufren algún tipo de alteración oral, tales como linfoadenopatías cervicales, palidez de la mucosa oral, petequias y/o equimosis, úlceras orales, agrandamiento gingival por infiltración celular, parestesia, lesiones óseas y de tejidos duros, movilidad dentaria e infecciones orales.10 El linfoma maligno es una transformación neoplásica que reside en el tejido linfoide. Los más comunes son el Linfoma no Hodking (LNH) y la enfermedad de Hodking, no relacionados entre sí. La principal importancia de esta patología reside en el diagnóstico de adenopatías sospechosas, de aumento de tamaño rápido en ausencia de foco infeccioso, no dolorosa y de consistencia firme y elástica que dura más de un mes. 10 El mieloma múltiple es una neoplasia maligna caracterizada por la proliferación de células plasmáticas procedentes de un único clon celular. Entre las afectaciones orales destacan las lesiones osteolíticas de maxilar y mandíbula, dolor, fracturas patológicas, parestesias, disfunción temporomandibular y tumoraciones en tejidos blandos.10 Las fracturas patológicas, el signo más común de la enfermedad, se debe a la mayor actividad de osteoclastos que debilitan el hueso. El siguiente signo más común son las infecciones, producidas por la no funcionalidad de las inmunoglobulinas que, próximos a trayectos nerviosos, podrían producir incluso parestesia.10
COMPLICACIONES Y PATOLOGIA ORAL RELACIONADA CON LA QUIMIOTERAPIA
El tratamiento del cáncer, y entre ellos la terapia del cáncer de cabeza y cuello, tiene una serie de efectos secundarios que pueden aparecer en la cavidad oral. Dichas lesiones pueden aparecer en la cavidad oral debido a un efecto local, como ocurre en el tratamiento de radioterapia de cabeza y cuello, o a un efecto sistémico por ejemplo producido por los quimioterápicos, ya que la replicación celular del epitelio oral es alta.
Los principales efectos adversos debidos al tratamiento del cáncer que aparecen en la cavidad oral son la hiposalivación, el aumento del riesgo de caries (debido en muchos casos a la falta de flujo salival), el síndrome de fibrosis por radiación, la mucositis por quimio o por radioterapia, la neuropatía secundaria al tratamiento de quimioterapia, la disgeusia, la disfagia, y la aparición de diferentes lesiones de la mucosa oral como el aumento de la susceptibilidad a infecciones orales.
Para poder minimizar los efectos secundarios del tratamiento oncológico, es necesario realizar una historia clínica completa y detallada, incluyendo no sólo datos básicos de anamnesis y exploración, sino además de información acerca de la historia oncológica del paciente, esto es, antecedentes previos de cáncer, ya que un paciente con historial oncológico previo tiene mayor probabilidad de desarrollar otro tumor, el tiempo y tipo de tratamiento, y sobre todo la medicación y tiempo desde que finalizó el tratamiento oncológico, ya que las complicaciones a largo plazo derivadas de la radiación o del uso de los bifosfonatos orales pueden aparecer a largo plazo.
Generalmente, se intenta que el paciente oncológico acuda a revisión a la consulta dental antes de comenzar el tratamiento oncológico; de hecho, son muchos los oncólogos que refieren a los pacientes al odontólogo para realizar un plan de tratamiento dental previo. 11 Se le ha de realizar una correcta historia clínica, un examen extraoral e intraoral minucioso, un estudio microbiológico de la flora oral actual, diagnósticos y monitorización por imagen, y un estudio de la cantidad de salivación previa al tratamiento oncológico. 11 La quimioterapia, como concepto estricto, es el uso de productos químicos para el tratamiento de cualquier enfermedad. Si hablamos de quimioterapia en cáncer, se le denomina antineoplásica, que consiste en el uso de fármacos capaces de afectar a la célula cancerosa, evitando su proliferación y/o aniquilándola aprovechando la mayor velocidad de ciclo de estas células. Es un tratamiento poco selectivo, ya que también afecta a las células normales con un ciclo de producción acelerado. Para el cáncer de cabeza y cuello los más utilizados son el metotrexato, el 5-fluoracilo, el cisplatino y oxaliplatino y la bleomicina. 10 Mucositis Se estima que un 40% de los pacientes tratados con quimioterápicos como el 5-fluoracilo sufren mucositis oral, con lesiones que aparecen entre los días 5 y 7 de tratamiento. Durante las primeras 24 horas el fármaco presenta una alta citotoxicidad y especificidad entre células tumorales y sanas, por lo que afecta a su vez células sanas de la cavidad oral.12, 13
Se han estudiado diferentes fármacos quimioterápicos, como el 5-fluoracilo, metrotrexato y irinotecán producen el aumento del factor de crecimiento tumoral, IL-1 e IL-6. 14
Las manifestaciones orales en este caso aparecen a los 3-4 días del tratamiento de quimioterapia y duran en torno a 15 días tras la última administración, y éstas son más severas cuanto más severo es el tratamiento oncológico.
La forma clínica de presentación es similar a la mucositis por radioterapia, apareciendo úlceras dolorosas. 15
Se han estudiado, dentro de los factores de riesgo, además de los relacionados con el tratamiento oncológico en sí, la implicación genética según la severidad de presentación de la mucositis. 14, 15 Xerostomía e hiposialia Es poco frecuente en el tratamiento con quimioterapia, y suele ser transitoria y generalmente reversible. El paciente refiere una sensación de gusto metálico que más tarde se podría transformar en alteraciones en el habla y la masticación.10, 13 Infecciones Debido a la mayor prevalencia de mucositis, se puede producir la infección de estas lesiones y también la pérdida de continuidad de las barreras epiteliales que contribuyen a la aparición de infecciones. Además, los pacientes debido a las molestias de la mucositis tienen una defectuosa higiene oral y debido al tratamiento oncológico una depresión de su sistema inmune. Los pacientes tratados con quimioterapia tienen déficit neutropénico, especialmente los siguientes 7 días después del ciclo, por lo que tienen un mayor riesgo de infección y de susceptibilidad a la muerte. Entre las infecciones más frecuentes se encuentran la enfermedad periodontal, fuente de entrada de numerosos microorganismos al torrente sanguíneo.
También se han descrito infecciones víricas por el virus herpes simple y virus herpes zóster o fúngicas como la infección por cándida albicans. 13, 16 (Figura 1) Hemorragias Debido a las alteraciones plaquetarias, trombocitopenia, que produce el tratamiento oncológico pueden aparecer en la cavidad oral petequias, equimosis, hematomas o hemorragias difusas. El paciente tratado con quimioterapia generalmente va a tener un recuento plaquetario bajo, no deben realizarse tratamientos dentales invasivos en aquellos pacientes que tengan menos de 70.000 plaquetas y 1.000 leucocitos.10, 13 Osteonecrosis por bifosfonatos y otros fármacos antiangiogénicos Los bifosfonatos son análogos estables de los pirofosfonatos inorgánicos que tienen especial afinidad al calcio e inhiben la actividad osteoclástica. Según la duración del tratamiento con este medicamento, puede permanecer en el organismo durante años.
Normalmente, se utilizan para el tratamiento de enfermedades con manifestaciones osteolíticas asociadas a osteoporosis, enfermedad de Paget, hipercalcemia maligna y mieloma múltiple.
Aunque se utilizan sobre todo en pacientes con osteoporosis, también se emplean en el tratamiento de pacientes con cáncer para ayudar a reducir la pérdida ósea en lesiones metastásicas óseas, así como a evitar fracturas óseas por mieloma múltiple y metástasis de tumores sólidos. El tipo y la vía de administración dependerá de la patología a tratar y de la potencia del medicamento. Como ya sabemos, los orales son más empleados para tratar la osteoporosis y los intravenosos en tratamiento oncológico. Esto es importante tenerlo en cuenta, ya que las complicaciones de ONM por bifosfonatos son más comunes en los intravenosos. Los más empleados en el tratamiento del cáncer son el pamidronato (Aredia, Linoten, Pamifos), ácido zolendrónico (Zometa, Aclasta) y el etidronato (Didronel, Disfofen, Osteum). Además, a la hora de administrar el medicamento, se tendrá en cuenta el estado sistémico del paciente, como por ejemplo la diabetes, el estadio del cáncer, o la toma de otros medicamentos inmunosupresores. También son importantes las infecciones previas del paciente y la historia previa de osteonecrosis por radiación. 10, 17, 18
Ya que las principales funciones de los bifosfonatos son la inhibición de la actividad osteoclástica, la inhibición de la reabsorción osteoclástica mediada por osteoblastos y la angiogénesis estos pueden producir lesiones en la cavidad oral.19 En la cavidad oral, donde los microtraumas se suceden de forma repetida debido a su función, pueden aparecer lesiones de osteonecrosis debido a la imposibilidad de reparación ósea tras una cirugía u otro trauma. Estas lesiones además pueden sobreinfectarse. 10
En estadios iniciales no se suelen observan cambios radiográficos y el paciente se encuentra asintomático, en algunos casos puede aparecer dolor severo resultado de la necrosis ósea que puede estar o no sobreinfectada. La ONM es un proceso progresivo que puede dar lugar a áreas extensas de dehiscencia y exposición ósea, que pueden resultar en una infección aguda y una sensación más severa de dolor y parestesia por compresión periférica nerviosa. 10
Por lo tanto, el diagnóstico de la ONM ha de hacerse basándose en la historia clínica del paciente y los signos y síntomas. Habrá de determinarse el correcto diagnóstico con una serie de criterios, entre los que destaca la historia médica de BF, tanto orales como intravenosos, área de exposición ósea y falta de resolución en un período de 8 semanas. Hasta que no se completen esas 8 semanas, no se podrá realizar un diagnóstico de ONM. 20
El protocolo a seguir en estos casos deberá incluir un desbridamiento óseo y curetaje, irrigación local con colutorios antisépticos como clorhexidina al 0,12%, la aplicación de oxígeno hiperbárico y la antibioterapia a nivel sistémico.
Existen otros nuevos fármacos, que se emplean en el tratamiento oncológico, con acción antiangiogénica que pueden producir además ONM. Entre ellos se encuentran fármacos inmunoterápicos como el denosumab (Xgeva) que se utiliza en el tratamiento de la metástasis ósea, o fármacos que tienen su diana en el factor de crecimiento endotelial como el sunitimib (Sutent), Sorafenim (Nexavar), Bevacizumib (Avastin) y sirolimus (Rapamune). El uso de estos fármacos de forma concomitante con los bifosfonatos, son actualmente factores de riesgo de ONM. Éstos últimos, se emplean sobre todo en el tratamiento del cáncer gastrointestinal, renal, pancreático o metástasis de cáncer de colon, recto y pulmón. 10, 21 Neurotoxicidad y dolor Estos efectos generalmente son autolimitantes, ya que desaparecen al terminar el tratamiento farmacológico. Los síntomas comunes incluyen fatiga, neuropatía y alteraciones cognitivas. El mecanismo de acción de estos efectos es aún desconocido, aunque se relaciona con inflamación, estrés oxidativo y daño en el ADN celular. 15
Generalmente los efectos secundarios neurotóxicos se dan más en población infantil, como describiremos en el apartado propio, pero hay estudios que refieren que más de la mitad de los pacientes estudiados tratados con derivados de la vinca, de entre 28 y 63 años, han sufrido daño neuropático sin causa dental aparente con seguimiento radiográfico. El dolor comienza a los 2 días de la administración farmacológica y desaparece al finalizar el tratamiento. 22 Efectos secundarios de tratamiento oncológico en niños Durante y tras el tratamiento oncológico se dan en el paciente infantil una serie de efectos secundarios. Estos efectos adversos son frecuentes, dependiendo de la intensidad y el tiempo de duración del tratamiento antineoplásico, y condicionan la calidad de vida del paciente, agravando su situación e incrementando el riesgo de infección.
La neoplasia más frecuente en niños es la leucemia linfoblástica aguda, seguida de los tumores óseos, siendo la tasa de supervivencia en Europa del 70-75%.
La principal complicación es la mucositis, y ésta se da en mayor incidencia que en adultos, ya que el número de mitosis en un niño es mayor que en un adulto, pero suelen tener un ciclo más rápido por esta misma razón. Es imprescindible para el control de la manifestación una correcta higiene oral, promovida también por una educación del odontólogo. Para su tratamiento se han empleado medicamentos tales como, el sucralfato, la glutamina, la lidocaína, la clorhexidina, la nistatina y el láser de baja potencia, destinados a paliar los síntomas.
Otras manifestaciones son las sobreinfecciones víricas, fúngicas y bacterianas. Éstas se pueden evitar promoviendo una correcta higiene oral. La infección vírica más frecuente es la producida por el virus del herpes simple (VHS), cuya terapia es con antivíricos como el Aciclovir, y ésta se pauta en pacientes con altas recurrencias de los brotes o en trasplantados hematopoyéticos. Otros fármacos como el Famciclovir o Valaciclovir no están aprobados en niños por la FDA, por lo que el de elección sigue siendo el Aciclovir. En cuanto a las infecciones fúngicas, se dan por los tratamientos con corticosteroides y antibióticos de manera prolongada. La más común es la Candida albicans, y se trata con nistatina o fluconazol. Hay que hacer especial hincapié en la higiene oral, ya que estos medicamentos contienen azúcar y pueden predisponer a caries, especialmente en pacientes con xerostomía. También pueden experimentar hemorragias, sobre todo aquellos tratados con quimioterapia que pueda alterar los niveles celulares.
Otra manifestación es la xerostomía, que suele desaparecer pasadas las 24-48. El tratamiento sería sintomático, con medidas de apoyo como pilocarpina. También desarrollan trismo por fibrosis del aparato masticatorio, para ello pueden recibir tratamiento de fisioterapia.
En pacientes tratados con alcaloides de la vinca, como vinblastina, vincristina y vindesina, se puede desarrollar dolor neuropático no asociado a ningún origen dental pero de localización próxima, ya que suelen afectar a las ramas trigeminales y faciales. El dolor desaparece cuando dejan de administrarse el tratamiento oncológico.
Cuando los tratamientos oncológicos se dan en pacientes infantiles, las alteraciones en el desarrollo, tanto dental como craneofacial, son comunes. En dientes se puede dar microdoncia, alteraciones en la formación radicular, retraso de la erupción, hipoplasia de esmalte, anomalías anatómicas de la pulpa, hipodoncia o agenesia. Según la etapa de erupción y la formación del diente, afectan a la corona y a la raíz o únicamente a la raíz. Si el tratamiento se recibe antes de los 5-6 años, hay una alta incidencia de efectos secundarios. Las anomalías del desarrollo craneofacial se ven con mayor frecuencia en pacientes que reciben radioterapia para el tratamiento de un tumor primario localizado en la región de cabeza y cuello. Una dosis de radiación alta, esquemas terapéuticos largos de radiación y una edad temprana al inicio de la terapia están asociadas con defectos más pronunciados y una asimetría facial importante debido al daño de los huesos en crecimiento.23, 24
MANEJO ODONTOLÓGICO DEL PACIENTE TRTADO CON QUIMIOTERAPIA
El principal factor de riesgo en las complicaciones orales del tratamiento oncológico son las patologías dentales previas y la higiene oral, por lo que es importante instruir al paciente oncológico en educación y posibles complicaciones.
Existen tres situaciones según el período de tratamiento del paciente: antes del comienzo de su tratamiento oncológico, durante, o después. Lo ideal es establecer un plan de tratamiento dental previo, pero el paciente suele acudir cuando ya ha sido tratado del cáncer. 10 Consideraciones previas al tratamiento Además de una correcta y completa historia clínica, es muy importante monitorizar los cambios y prevenir futuros problemas educando acerca de una correcta higiene oral, evitar dieta cariogénica, realizar profilaxis con flúor y eliminando posibles irritantes y procesos infecciosos.10, 25 Respecto al estado odontológico, los dientes con pronóstico reservado deberán extraerse y aquellos con vitalidad negativa deberán endodonciarse. Se deberán priorizar los tratamientos periodontales conservadores (profilaxis y raspado y alisado radicular) y aconsejar al paciente no ponerse las prótesis removibles durante el tratamiento para evitar posibles traumas. 25 La extracción estará indicada en:
- Dientes periodontalmente comprometidos: bolsas de 6mm, movilidad o secreción purulenta
- Inflamación periapical
- Dientes no restaurables o no funcionales
- Poca higiene por parte del paciente
- Asociación con inflamación (pericoronaritis) o infección10
El protocolo de actuación ante una extracción en este tipo de pacientes deberá de ser el siguiente:
- La cirugía deberá de ser lo más atraumática posible
- Las extracciones deberán de realizarse por lo menos 2 semanas antes de la radiación, idealmente 3 semanas antes de la radiación
- Al terminar la extracción deberemos de asegurarnos de eliminar bordes óseos filosos
- Realizar un cierre primario de la herida
- Evitar agentes hemostáticos que puedan ocasionar infección
- Realizar un eecuento plaquetario previo, con un mínimo de 50.000/mm3 plaquetas
- Suspender la extracción si la serie blanca <2.000/mm3 o neutrófilos <1.000mm3
- Mandar pauta antibiótica con cefalosporinas después de la extracción10 Si el estado bucodentario es aceptable o bueno, se deberá tender a la concienciación de la higiene oral, cepillado con pastas fluoradas y aplicación de barnices o fluoraciones en consulta. También se hará hincapié en la extracción de piezas intratables o de pronóstico dudoso, con caries, abscesos o enfermedad periodontal. Se aplicará selladores de fosas y fisuras en niños jóvenes y se hará tratamiento conservador con amalgamas o ionómeros de vidrio. Se tenderá también a la realización de cirugías preprotésicas para que las prótesis sean lo más atraumáticas posibles, y se evitará una nueva prótesis al menos 1 año antes del tratamiento oncológico 10. Se quitarán las prótesis metálicas antes del tratamiento, y las piezas semi impactadas se extraerán. 25 En cuanto a los tiempos de espera antes del tratamiento oncológico, dependerán de la complejidad de los tratamientos. Por ejemplo, ante un tratamiento agresivo como es la escisión de un torus o de un cordal, se deberá hacer 3-4 semanas antes del tratamiento. Para realizar extracciones normales se deberá esperar al menos 21 días. En tratamientos periodontales, se hará extracción de dientes con bolsas superiores a 7mm, raspaje y alisado radicular de piezas de entre 4 y 6mm y profilaxis en bolsas de 3mm o menos.10, 25 Consideraciones durante el tratamiento Durante el tratamiento oncológico se deberá evitar realizar tratamientos odontológicos de rutina y sólo se realizarán tratamientos de urgencia. Se deberá insistir en el control de la higiene y tratar y prevenir las lesiones orales asociadas al tratamiento oncológico.10 Se tendrán que evitar agentes irritantes mecánicos (como prótesis mal adaptadas), físicos y químicos. Se instruirá al paciente en evitar una dieta cariogénica y se intentarán utilizar protectores de glándulas salivales, como la amifostina aprobada por la FDA, y hueso maxilar, así como en el uso de férulas específicas para proteger los dientes durante el tratamiento de radioterapia. 26 En cuanto a la mucositis, es dosis dependiente y desaparece de 1 a 2 semanas finalizado el tratamiento.10
El principal objetivo será mantener la integridad de la mucosa en picos agudos y educar en higiene oral. Se seguirán unas pautas terapéuticas:
- Enjuagues de agua con sal y clorhexidina al 0,12%
- Anestésicos tópicos locales y antiinflamatorios en periodos de dolor leves. Ante periodos más severos corticoides tópicos en orobase.
- Hidratación continua y dieta blanda
- Evitar alcohol, tabaco,comida irritante y bebidas carbonatadas
- Las prótesis no deberán colocarse hasta que se solucione el brote agudo Si aparece mucositis, no se deben usar las prótesis removibles hasta que se solucione el brote agudo, y éstas deben ser higienizadas correctamente. 10
En un metaanálisis publicado en 2006 por Clarckson y colaboradores, se estudiaron 42 ensayos clínicos sobre un total de 10.514 pacientes, y se vio la efectividad de la crioterapia (aplicación de frío a nivel local), y el factor de crecimiento de queratinocitos. 34 La mucositis se puede tratar de manera farmacológica con agentes antioxidantes. La glutamina, un aminoácido con propiedades antioxidantes, no se aconseja usar en el tratamiento de mucositis debido al tratamiento oncológico, ya que es precursor de la síntesis de nucleótidos y mitosis celular. 10, 14 También se han estudiado suplementos del zinc, que actúan en la proliferación celular, o suplementos de vitamina E como el tocofenol o la vitamina A. 14, 27
El láser de baja potencia es una terapia lumínica que estimula la regeneración tisular, y controla el dolor, además es no citotóxica y no tiene efectos adversos. Esta terapia también se emplea en el tratamiento de la mucositis, generalmente en unas longitudes de onda de entre 633-685 o 780-830 nm 28, 29 También aparecen infecciones secundarias al estar disminuida la serie blanca, por lo que deberá tenerse en cuenta la posible infección oportunista por Candida. Si apareciera candidiasis deberá ser tratada con enjuagues de Nistatina 100.000 IU/ml de 4 a 5 veces al día, y si la infección persistiera, se podría optar por tratamiento con Fluconazol. Si existieran infecciones bacterianas secundarias que cursen con afectación sistémica, éstas suelen ser Gram-negativas, por lo correcto es realizar un antibiograma para prescribir el tratamiento antibiótico adecuado.
Respecto al tratamiento de enfermedades víricas. En algunos casos para prevenir infecciones por virus del herpes simple, si es portador del virus, se aplicarán medidas profilácticas con Aciclovir, famciclovir o valaciclovir para evitar brotes. 10, 24, 25 Los pacientes oncológicos tratados con quimioterapia pueden tener disminuidas las plaquetas. Si es necesario realizar algún tratamiento quirúrgico habrá que tener en cuenta medidas hemostáticas locales y realizar sutura de la herida para favorecer el cierre primario. La presencia de placa e inflamación gingival se ve agravada en estos pacientes. El paciente puede tener sangrado gingival espontáneo. Si apareciera este problema, se pueden realizar enjuagues antifibrinolíticos con ácido aminocaproico 250mg/ml, hasta que se pudiera realizar el tratamiento periodontal necesario.10, 25 En cuanto a los cambios neuronales y quimiosensitivos, los cambios en el sabor de los alimentos son muy comunes y se tratan con suplementos de zinc de 220mg 2 veces al día hasta restablecer el sentido del gusto. El paciente podría sentir un dolor similar al odontogénico asociado a pulpitis irreversible. Siempre habrá que realizar un correcto diagnóstico diferencial: habrá que hacer un parte interconsulta para descartar que el paciente no esté recibiendo tratamiento de quimioterapia asociado a dolor neuropático, este dolor suele ser bilateral y en zonas posteriores, y se asocia a normalidad radiográfica. En estos casos normalmente desaparece el dolor cuando acaba el efecto de dicho tratamiento. Si no se ve un problema odontológico se evitará realizar tratamientos innecesarios. 10, 22, 24 Valores analíticos a tener en cuenta durante la quimioterapia: 25
- Evitar tratamientos de 17 a 20 días después del ciclo
- Recuento de granulocitos > 2.000 células/mm3
- Recuento plaquetario > 5.000 células/mm3
Consideraciones post-tratamiento oncológico
Debido al aumento de esperanza de vida en pacientes oncológicos, cada vez más se van a encontrar pacientes con secuelas posteriores al tratamiento oncológico.28
Numerosos fármacos quimioterápicos tienen un amplio espectro hematológico, por lo que estos pacientes pueden tener anemia, leucopenia, neutropenia y trombocitopenia, aunque éstos desaparecen finalizado el tratamiento, los pacientes tienen una mayor probabilidad de infecciones.10, 15
El paciente tratado con quimioterapia tendrá xerostomía transitoria.28 Esta hiposalivación genera mayor susceptibilidad de caries en el paciente, por lo que la higiene minuciosa y la aplicación de flúor en clínica son medidas preventivas que el paciente debe llevar a cabo. 10, 15, 25 El tratamiento de falta de lubricación se centra en la reposición de líquidos mediante la ingesta. Además se debe evitar el alcohol, café, té, tabaco y comidas picantes. En aquellos casos en los que quede función residual se valorará el uso de pilocarpina o cevimelina para estimular la función salival.
Si aparecieran lesiones orales asociadas a la hiposialia, como por ejemplo lesiones ulcerosas que persistan en boca durante más tiempo del normal para su cicatrización, se tratarán manteniendo el balance oral con corticoides (acetónido de triamcinolona o,1% en orabase), y si éstas se sobreinfectan, se deberá realizar una terapia antimicótica con nistatina. 10 La mielosupresión que produce la quimioterapia produce muositis, hiposalivación, y una menor motivación por parte del paciente de cara a la higiene oral, lo que hace que sea más susceptible a sobreinfecciones micóticas que deben tratarse con enjuagues de Nistatina 100.000 IU/ml de 4 a 5 veces al día, con especial cuidado en el contenido de azúcar y la necesidad de higienizarse la boca tras cada enjuague. 10, 15 En cuanto a la ONM por fármacos antiangiogénicos, se establece como tratamiento preventivo, comenzando por un parte interconsulta con su médico especialista para determinar el diagnóstico concreto y la farmacoterapia actual del paciente, previniendo complicaciones, para lo que tendría que hacerse un examen exhaustivo, mantener una salud periodontal e higiene exquisita, extracción de piezas dudosas, obturaciones. En caso de necesitarse, se realizará el tratamiento dental rutinario, con los anestésicos locales diarios, siempre de la manera más atraumática posible, removiendo los fragmentos de hueso en caso de una ONM sin realizar procedimientos quirúrgicos complejos y bajo farmacoterapia antibiótica sistémica. 25
Si se ha instaurado la ONM:
Según su estadio, se establecerá un tratamiento específico:
Pacientes con riesgo de padecer necrosis, que clínicamente no tienen hueso necrótico pero han sido tratados con BF, no hay tratamiento específico indicado, pero sí educación y concienciación de los signos y síntomas y de los factores de riesgo asociados.
Pacientes en estadio 0 de la enfermedad, donde no hay evidencia de hueso necrótico pero se encuentran hallazgos no específicos y cambios radiográficos asociados a síntomas. Se hará un tratamiento sintomático y manejo conservador de caries y enfermedad periodontal y tratamiento antibiótico si fuera necesario, además de monitorizar al paciente. Habría que descartar también enfermedad fibroósea y osteomielitis esclerótica crónica.
Pacientes en estadio 1 de la enfermedad, donde hay un área de hueso necrótico expuesto o fístula ósea, pero asintomática y sin evidencia infecciosa, deberán tratarse con enjuagues de clorhexidina al 0,12% 2 veces/día durante 15 días, y valorar en ese momento si la sintomatología ha aumentado o no. Si ha aumentado, se aplicaría el tratamiento del estadio 2; si no ha aumentado, se controlaría al mes, y si ha remitido por completo se finalizaría el tratamiento y si no, se pasaría al estadio 2.
Pacientes en estadio 2, con hueso necrótico expuesto, fístula ósea e infección asociada con dolor y eritema regional del hueso expuesto con o sin drenaje purulento. Habría que aplicar enjuagues antisépticos de clorhexidina 0,12% 2 veces/día durante 15 días además de terapia antimicrobiana, especialmente de elección las penicilinas. Alérgicos a penicilinas se suele emplear quinolonas, metronidazol, clindamicina, doxiciclina o eritromicina. Se puede hacer también un antibiograma.
También deberá aplicarse una terapia analgésica potente para controlar el dolor.
Si la lesión ha mejorado a los 15 días, se pasa al estadio 1 y se controla al mes, y si no ha mejorado, se pauta la misma pauta 15 días más y se hará una prueba 3D. Se controlará al mes y si persiste, se pasa al tratamiento en estadio 3.
Pacientes en estadio 3, con hueso necrótico expuesto, fístula ósea, dolor, infección y uno o más de los siguientes criterios: hueso necrótico que se extiende más allá de la región alveolar, fractura patológica, fístula intraoral o extraoral, comunicación oral-antral u osteolisis del borde inferior de la mandíbula o del suelo del seno maxilar. En estos pacientes habría que hacer un desbridamiento óseo, incluyendo resección en combinación con tratamiento antibiótico, que producirá una resolución de la forma aguda a largo plazo. En caso de haber comunicación al exterior, se procedería a utilizar obturadores. Se tendría que utilizar clorhexidina al 0,12% 2 veces/día durante 15 días tras la cirugía, y se debería controlar a los 15 días; si mejora, se controla otra vez a los 15 días. Si la evolución es desfavorable, se mantendría la pauta 15 días y se pautaría revisión; si no mejora, se procedería a una nueva cirugía. 15, 19, 25 Consideraciones especiales en pacientes con tumores hematológicos En caso de leucemia, el tratamiento dental estará condicionado siempre por la tendencia a la infección y la hemorragia, debidas a la propia enfermedad, a alteraciones medulares o como consecuencia del tratamiento antineoplásico. Ante tratamientos dentales invasivos, siempre se tendrá que realizar profilaxis antibiótica y tratamiento antibiótico, preferiblemente con Amoxicilina + Ac. Clavulánico 875/125mg cada 8 horas durante 7 días, además de pauta antimicótica con nistatina/6h o fluconazol en casos de resistencia. 25
Si el tratamiento urge, se valorará la expectativa de vida del paciente y se pospondrá todo lo posible hasta que remita el brote agudo. Si fuera necesario el tratamiento, se intentará evitar la anestesia loco-regional si las plaquetas estuvieran alteradas y se evitarán todo lo posible las extracciones y procedimientos quirúrgicos, aún no complicados. Si el recuento plaquetario fuera insuficiente, se plantearía una trasfusión y medidas hemostásicas locales como la colocación de esponjas de Amchafibrin y cierre primario con sutura reabsorbible. En la tabla de la página siguiente podemos ver de forma detallada las lesiones orales más frecuentes de los pacientes con Leucemia.9, 10, 32
En caso de linfoma, deberá solicitarse una analítica previa al tratamiento dental para valorar el nivel de leucocitos y plaquetas, y el tratamiento odontológico deberá hacerse antes de la radioterapia y/o quimioterapia, además de tener en cuenta que la depresión medular puede ser por la propia enfermedad y no solamente por el tratamiento oncológico. Como medidas generales, si ha de realizarse un tratamiento, se empleará profilaxis antibiótica y antimicótica, además de medidas hemostásicas exhaustivas en caso de cirugía.25
En mielomas, no se realizarán tratamientos en fase activa y durante ciclos de quimioterapia, y siempre se hará profilaxis antibiótica y se pedirá una analítica que contenga fórmula leucocitaria, plaquetas, e inmunoglobulinas. Hay que tener especial cuidado con las medidas hemostásicas y la posible insuficiencia renal por el depósito de inmunoglobulinas, así como el tratamiento prolongado con corticoides que puede deprimir la función de la glándula suprarrenal. 25
CONCLUSIONES Es imprescindible el conocimiento de las repercusiones del tratamiento oncológico, sobre todo en aquellos pacientes tratados con radioterapia de cabeza y cuello, en la cavidad oral para minimizar los riesgos asociados previos, durante y posteriores al tratamiento. Es importante educar al paciente e insistir en la asistencia a las revisiones periódicas, además de la adecuación de todo tratamiento dental a la situación base del paciente para evitar posibles complicaciones que puedan originarse en la consulta. Para ello es importante tener una base firme acerca de los tratamientos empleados en cada tipo de cáncer y las repercusiones de cada uno de ellos.
BIBLIOGRAFÍA 1. Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C et al. GLOBOCAN 2012 V1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No.11 Lyon, France: Centro Internacional de Investigaciones sobre el Cáncer; 2013
2. Galceran, J., Ameijide, A., Carulla, M., Mateos, A., Quirós, J., Rojas, D., Alemán, A., Torrella, A., Chico, M., Vicente, M., Díaz, J., Larrañaga, N., Marcos-Gragera, R., Sánchez, M., Perucha, J., Franch, P., Navarro, C., Ardanaz, E., Bigorra, J., Rodrigo, P. and Bonet, R. (2017). Cancer incidence in Spain, 2015. Clinical and Translational Oncology, 19(7), pp.799-825.
3. Scully, C. and Bagan, J. (2009). Oral squamous cell carcinoma: overview of current understanding of aetiopathogenesis and clinical implications. Oral Diseases, 15(6), pp.388-399.
4. Sannigrahi, M., Singh, V., Sharma, R., Panda, N. and Khullar, M. (2014). Role of autophagy in head and neck cancer and therapeutic resistance. Oral Diseases, 21(3), pp.283-291.
5. Tsai, Y., Lee, K., Huang, J., Liu, Y., Juo, S., Kuo, W., Chang, J., Lin, C. and Jong, Y. (2008). Arecoline, a major alkaloid of areca nut, inhibits p53, represses DNA repair, and triggers DNA damage response in human epithelial cells. Toxicology, 249(2-3), pp.230-237.
6. Shield, K., Ferlay, J., Jemal, A., Sankaranarayanan, R., Chaturvedi, A., Bray, F. and Soerjomataram, I. (2016). The global incidence of lip, oral cavity, and pharyngeal cancers by subsite in 2012. CA: A Cancer Journal for Clinicians, 67(1), pp.51-64.
7. Chi, A., Day, T. and Neville, B. (2015). Oral cavity and oropharyngeal squamous cell carcinoma-an update. CA: A Cancer Journal for Clinicians, 65(5), pp.401-421.
8. Scully, C., Cawson, RA. Haematology III: Malignan disease. En: Scully C, Cawson Ra Eds. Medical problems in dentistry. 5ª ed. Oxford: Elsevier Churchill Livingstone 2005: 156-169.
9. Francisconi, C., Caldas, R., Martins, L., Rubira, C. and da Silva Santos, P. (2016). Leukemic Oral Manifestations and their Management. Asian Pacific Journal of Cancer Prevention, 17(3), pp.911-915.
10. Little, JW., Falace, D., Miller, CS., Rhodus, NL. Disorders of the White blood cells. EN: Little JW, Falace DA, Miller CS, Rhodus NL. Eds. Dental Management of the Medically Compromised Patients. St. Louis: Mosby 7ª ed. 2008. P. 373-95.
11. Levi, L. and Lalla, R. (2018). Dental Treatment Planning for the Patient with Oral Cancer. Dental Clinics of North America, 62(1), pp.121-130.
12. Mora-Montoya D., Gómez-García F.J., Yassin-Noreña L., López Jornet P., Vicente-Ortega V. (2016). Evaluación de terapias alternativas en mucositis oral experimental. Av Odontoestomatol; 32( 6 ): 291-300
13. Sroussi, H., Epstein, J., Bensadoun, R., Saunders, D., Lalla, R., Migliorati, C., Heaivilin, N. and Zumsteg, Z. (2017). Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis. Cancer Medicine, 6(12), pp.2918-2931.
14. Cinausero, M., Aprile, G., Ermacora, P., Basile, D., Vitale, M., Fanotto, V., Parisi, G., Calvetti, L. and Sonis, S. (2017). New Frontiers in the Pathobiology and Treatment of Cancer Regimen-Related Mucosal Injury. Frontiers in Pharmacology, 8.
15. Villa, A. and Akintoye, S. (2018). Dental Management of Patients Who Have Undergone Oral Cancer Therapy. Dental Clinics of North America, 62(1), pp.131-142.
16. Meurman, J. and Grönroos, L. (2010). Oral and dental health care of oral cancer patients: hyposalivation, caries and infections. Oral Oncology, 46(6), pp.464-467.
17. Melo MD, Obeid G. Osteonecrosis of the jaws in patients with a history of receiving bisphosphonate therapy. J Am Dent Assoc 2005;136:1675-1681.
18. Markiewicz MR, Margarone JE 3rd, Campbell JH, Aguirre A. Bisphosphonate-associated osteonecrosis (BON) of the jaws: A review. J Am Dent Assoc 2005; 136:1669-1676.
19. Migliorati CA. Bisphosphonate-associated osteoradio- necrosis: Position statement. J Am Dent Assoc 2005;136:12.
20. Sultan, A., Hanna, G., Margalit, D., Chau, N., Goguen, L., Marty, F., Rabinowits, G., Schoenfeld, J., Sonis, S., Thomas, T., Tishler, R., Treister, N., Villa, A., Woo, S., Haddad, R. and Mawardi, H. (2017). The Use of Hyperbaric Oxygen for the Prevention and Management of Osteoradionecrosis of the Jaw: A Dana‐Farber/Brigham and Women's Cancer Center Multidisciplinary Guideline. The Oncologist, 22(3), pp.343-350.
21. Omolehinwa, T. and Akintoye, S. (2016). Chemical and Radiation-Associated Jaw Lesions. Dental Clinics of North America, 60(1), pp.265-277.
22. McCarthy GM, Skillings JR. Jaw and other orofacial pain in patients receiving vincristine for the treatment of cancer. Oral Surg Oral Med Oral Pathol 1992;74:299-304.
23. Morris, L. and Ganly, I. (2010). Outcomes of oral cavity squamous cell carcinoma in pediatric patients. Oral Oncology, 46(4), pp.292-296.
24. Rabassa Blanco, J., Abril rojas, L., González Chópite, Y., Cahuana Cárdenas, A., Catalá Temprano, A. and Parareda Selles, A. (2011). Oral Complications in pediatric oncology patients. A review. Odontología pediátrica, 19(2), pp.117-127.
25. Machuca Portillo, G. and Bullón Fernández, P. (2013). Tratamiento odontológico en pacientes especiales. 3rd ed. Madrid: Laboratorios Normon, pp.399-432.
26. Clarkson, J., Worthington, H. and Eden, O. (2003). Interventions for preventing oral mucositis for patients with cancer receiving treatment. Cochrane Database of Systematic Reviews.
27. Chaitanya, N. (2017). Role of Vitamin E and Vitamin A in Oral Mucositis Induced by Cancer Chemo/Radiotherapy- A Meta-analysis. JOURNAL OF CLINICAL AND DIAGNOSTIC RESEARCH.
28. Zecha, J., Raber-Durlacher, J., Nair, R., Epstein, J., Sonis, S., Elad, S., Hamblin, M., Barasch, A., Migliorati, C., Milstein, D., Genot, M., Lansaat, L., van der Brink, R., Arnabat-Dominguez, J., van der Molen, L., Jacobi, I., van Diessen, J., de Lange, J., Smeele, L., Schubert, M. and Bensadoun, R. (2016). Low level laser therapy/photobiomodulation in the management of side effects of chemoradiation therapy in head and neck cancer: part 1: mechanisms of action, dosimetric, and safety considerations. Supportive Care in Cancer, 24(6), pp.2781-2792.
29. Zecha, J., Raber-Durlacher, J., Nair, R., Epstein, J., Elad, S., Hamblin, M., Barasch, A., Migliorati, C., Milstein, D., Genot, M., Lansaat, L., van der Brink, R., Arnabat-Dominguez, J., van der Molen, L., Jacobi, I., van Diessen, J., de Lange, J., Smeele, L., Schubert, M. and Bensadoun, R. (2016). Low-level laser therapy/photobiomodulation in the management of side effects of chemoradiation therapy in head and neck cancer: part 2: proposed applications and treatment protocols. Supportive Care in Cancer, 24(6), pp.2793-2805. 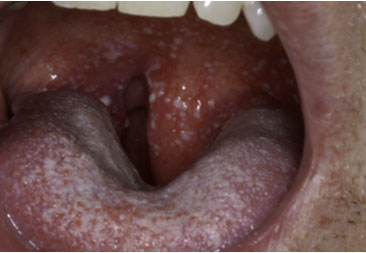 Figura 1. Candidiasis pseudomembranosa. 11
|
 Información General
Información General Artículos
Artículos Notícias
Notícias Enlaces
Enlaces Contactar
Contactar Buscar
Buscar Premio Nadal
Premio Nadal Formación Continuada
Formación Continuada
