| |
Paredes Andreina1, Ortiz Reynaldo2, Velazco Gladys1, Rojas Daniela3
Cátedra de Materiales Dentales. Facultad de odontología. Universidad de Los Andes. Mérida Venezuela
Laboratorio de Electroquímica. Facultad de Ciencias Universidad de Los Andes. Mérida Venezuela
Odontológo egresada de la Facultad de Odontología - Universidad de Los Andes. Mérida VenezuelaCorrespondencia: Av. 3 entre calles 22 y 23 edificio adjunto al Rectorado, Facultad de Odontología Universidad de Los Andes. Mérida Venezuela
E-mail: andrepar90@gmail.com RESUMEN
En el área de ortodoncia, los arcos de Níquel - titanio (NiTi) son los más utilizados, y se ha encontrado que pueden sufrir procesos de corrosión y deterioro estructural, debido al ambiente bucal. El objetivo de este estudio fue evaluar in vitro mediante curvas de polarización cíclica, la velocidad en que el ion fluoruro produce corrosión sobre los alambres de NiTi. El estudio se realizó mediante un sistema electroquímico de tres electrodos en una celda de un compartimiento, las soluciones inductoras y medios electrolíticos fueron preparados a diferentes concentraciones de fluoruro de sodio. Se evidenciaron procesos de corrosión por picadura, lo cual infiere que las distintas concentraciones de NaF afectan con gran importancia la estructura de los alambres de NiTi, deteriorando sus propiedades.
Palabras claves: Arcos ortodónticos, corrosión, Aleaciones de NiTi, ortodoncia ABSTRACT
In the area of orthodontics, arches Nickel - titanium (NiTi) are the most used, and found that processes can suffer corrosion and structural deterioration due to the oral environment. The aim of this study was to evaluate in vitro using cyclic polarization curves, the rate at which corrosion occurs fluoride ion on NiTi wires. The study was conducted by a three-electrode electrochemical system in a cell in a compartment, and inducing electroplating solutions were prepared at different concentrations of sodium fluoride. Processes showed pitting corrosion, which infers that the different concentrations of NaF with great importance affect the structure of NiTi, deteriorating its properties.
Keywords: Orthodontic Arcos, corrosion, NiTi alloys, orthodontic INTRODUCCIÓN
Dentro de la odontología, el área de ortodoncia es la responsable de la supervisión, guía y corrección de problemas del crecimiento y maduración de estructuras dentofaciales mediante la aplicación de fuerzas mecánicas y funcionales para estimular y redirigir el complejo cráneo facial (1). Dicha corrección se lleva a cabo con el uso de aparatos ortodónticos fijos, los cuales incluyen arcos ortodónticos entre otros elementos. Los arcos son los componentes más activos e importantes de la aparatología fija, están constituidos por diferentes aleaciones metálicas y su función es mover los dientes en un plano en el espacio permitiendo la corrección de problemas dentofaciales (2).
Se ha demostrado que cuando se emplean materiales restauradores dentales metálicos o alambres de ortodoncia, se generan corrientes galvánicas asociadas al medio corrosivo, continuamente presente en la cavidad oral(3). Para todos los propósitos prácticos, los alambres de ortodoncia no pueden ser aislados eléctricamente del diente. Por lo tanto la resistencia a la corrosión es críticamente importante para alambres de ortodoncia, debido a que la corrosión puede dar lugar a rugosidad en la superficie, lo que debilita los aparatos y se liberan los iones del metal o aleación. La liberación de elementos puede producir decoloración de los tejidos blandos adyacentes y reacciones alérgicas en pacientes susceptibles(4,5,6). La corrosión puede limitar gravemente la vida de fatiga y resistencia a la rotura del material. Algunas aleaciones y metales son resistentes a la corrosión a causa de su nobleza inherente o a la formación de una capa superficial de protección.
Los alambres de Níquel - titanio (NiTi) son los más utilizados en el área de ortodoncia, los cuales sufren cambios estructurales en un tiempo de uso prolongado debido a la exposición de múltiples factores propios de la cavidad bucal(7); las aleaciones ortodónticas liberan iones metálicos por causas multifactoriales, dependiendo de las características del material y los factores propios y externos del individuo (8). Una de las causales externas es la acción ácida fluorada que se da por el uso regular de agentes profilácticos fluorados en la higiene diaria de la cavidad bucal, que podrían aumentar el proceso corrosivo de los alambres ortodónticos, produciendo efectos negativos estructurales en dichos elementos (9).
El fluoruro de sodio (NaF) presente en los dentríficos bucales, ha demostrado ser capaz de corroer con facilidad los alambres de NiTi (10,11), el objetivo de este estudio fue evaluar in vitro mediante una curva de polarización cíclica la velocidad en que el fluoruro de sodio produce corrosión sobre los alambres de NiTi utilizados en ortodoncia. MATERIALES Y MÉTODOS
El estudio se realizó mediante un sistema electroquímico de tres electrodos en una celda de un compartimiento, el cual se compone de un electrodo de trabajo (ET) confeccionado con un arco ortodóntico de NitiMorelli® soportado por una pipeta Pasteur, en el cual ocurre la reacción electroquímica de interés; un contraelectrodo de Platino (Pt) y un electrodo de referencia plata/cloruro de plata (Ag/AgCl) el cual es utilizado para controlar el potencial en el ET(12).
Las soluciones inductoras y medios electrolíticos de las celdas electroquímicas fueron preparadas a diferentes concentraciones y así obtener cuatro muestras: Saliva artificial 25ml sin modificaciones (muestra 1); saliva artificial 25ml 1% NaF (0,25mg NaF) (muestra 2), saliva artificial 25ml 2% NaF (0,50mg NaF) (muestra 3), saliva artificial 25ml 3%NaF (0,75mg NaF) (muestra 4). La temperatura se mantuvo constante a 37°C con el baño termostatizado marca Thomas Scientific modelo 9106, con la finalidad de simular la temperatura bucal. El estudio se realizo para 4 alambres idénticos.
Las experiencias voltametricas se llevaron a cabo utilizando un Potenciostatogalvanostato marca EcoChemie, acoplado a un computador dotado con el software GPES versión 4 también de EcoChemie, para la adquisición y el manejo de datos. Para cada medio se trabajó en intervalos de potencial de -1,5V hasta 1,5V, mediante voltagrama cíclico a una velocidad de barrido de 5 mV/s, con los datos de corriente y potencial obtenidos, se grafican las porciones anódicas y catódicas Log(E) en función de Log(I) y con las rectas de Tafel por extrapolación se encuentran los potenciales y velocidades de corrosión(12).
Para el cálculo de la densidad de corriente de corrosión, se tomó en cuenta el área geométrica del electrodo, para la determinación de las densidades de corriente. Finalmente, se determinó la velocidad de corrosión de cada una de las muestras con la siguiente ecuación: V=JcorrosiónxPA/nF (siendo n el número de electrones transferido durante el proceso de corrosión, F la contante de Faraday (96.500 C/mol) y PA el peso atómico del metal.
Los estudios de microscopía electrónica se realizaron empleando un microscopio electrónico de barrido Hitachi modelo S-2500. RESULTADOS Y DISCUSIÓN
A continuación se muestra la curva de polarización cíclica (voltagrama cíclico) , obtenido para un alambre de NiTi en una solución de saliva artificial en ausencia de ion fluoruro (figura 1); en este caso se observa durante el barrido anódico una corriente inicial en el intervalo de potencial de -1,5 hasta -0,54 V, a partir del cual se produce una pasivación del alambre, hasta que se alcanza un potencial de 1,35 V , en donde la corriente crece de manera abrupta , debido a los procesos de disolución del electrodo y/o descomposición del medio electrolítico. En el proceso inverso se observa nuevamente la zona de pasivación y la aparición de una onda catódica con un pico de reducción a -1,2 V; la cual se puede atribuir a la reducción de óxidos superficiales concomitante a la reducción del ion hidrógeno del medio electrolítico. Mediantes gráficos de Tafel se obtuvo una densidad de corriente de corrosión 8,57x10-7 A.cm-2 y el potencial de corrosión en -0,546V. 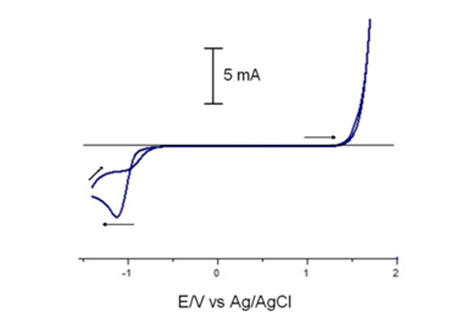 Figura 1.- Respuesta voltamétrica de un alambre de NiTi, sumergido en saliva artificial en ausencia de ion fluoruro. En la figura 2, se muestran las curvas de polarización cíclica, obtenidas para alambres de NiTi en las soluciones de 1, 2 y 3 % de NaF en saliva artificia; para todos los casos, se observa en barrido anódico, la pasivación del electrodo de NiTi, debida a la formación de óxidos superficiales, sin embargo, a diferencia a lo observado en ausencia de ion fluoruro, aparece una onda anódica a un potencial de 1,4 V y durante el barrido de retorno se observa la aparición de una onda de oxidación, indicando que la película pasiva se ha disuelto o deteriorado, dejando expuesta la superficie metálica, por lo cual se produce la corrosión de la misma.
De esta manera la onda que aparece en los voltagramas de las soluciones contentivas de ion fluoruro, entre 1,2 y 1,5 V, se puede atribuir a la disolución ya sea completa o en parte, de la película de óxidos pasivos, esto, debido a la influencia del ion fluoruro, el cual es capaz de formar complejos solubles de Ni y Ti (13). 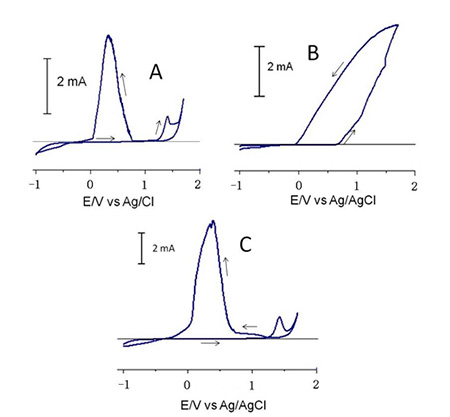
Figura 2.- Respuesta voltamétrica de 3 alambres de NiTi, sumergido en saliva artificial en ion fluoruro A) 1% B) 2% C) 3%
Microscopía Electrónica de Barrido SEM
Se observó la morfología de las superficies pormicroscopía electrónica de barrido. La microscopíamuestra corrosión localizada, corrosión por picadoen toda el área del material, mostrando pérdida del mismo, en la figura 3 se pueden observar las micrografías de los alambres sometidos a estudio en todas las soluciones, en donde para todos los casos se puede apreciar restos de una película formada, la cual corresponde a la capa pasiva que luego se fragmenta, en un todo de acuerdo con los resultados voltamétricos.

Figura 3.- Micrografías electrónicas de barrido de los alambres de Ni-Ti, luego de haber sido estudiados por Voltametría: A) Alambre pulido antes de ser sometido a estudio, B) Saliva artificial, C) 1 % NaF D) 2 % NaF E) 3% de NaF Lasvelocidades de corrosión en g.año/cm2, calculadas a partir de las corrientes de corrosión, se muestran en la tabla 1.
Tabla 1.- Potenciales y velocidades de corrosión obtenidas a partir de las curva de Tafel
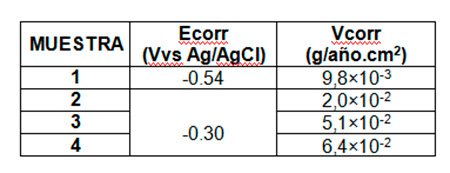
En el estudio electroquímico se evidenció un cambio de potencial importante; aunque el potencial de corrosión aumenta, también lo hace la corriente de corrosión a medida que aumenta la concentración de NaF afectan con gran importancia la estructura de los alambres de NiTi, este aumento en la velocidad de corrosión, produce deterioro en las propiedades de dichos alambres. Estos resultados son semejantes a los que reporta Ospino y Navarro 2009 y Schiff, et al 2006 (14,15), quienes evaluaron la conducta corrosiva de los alambres de NiTi en saliva artificial y enjuagues bucales con fluoruros, mostrando un proceso corrosivo en todas las muestras de alambres de NiTi evaluadas, afirmando la consideración de que tanto el medio ambiente bucal, el NaF contenido en soluciones y los componentes de la aleación influyen en la corrosión del material de NiTi(14). Asimismo, el estudio reportado por Lijima et al 2010(16) difiere de estos resultados, afirman que no ocurren procesos corrosivos en las aleaciones de NiTi al entrar en contacto con NaF, observándose mediante polarización y Microscopía electrónica de barrido(15). CONCLUSIONES
Los aumentos bruscos de corriente demostraron la aparición de procesos corrosivos los cuales se evidenciaron en las cuatro muestras, determinándose una pérdida de las propiedades estructurales de los alambres de NiTi, lo cual muestra que el uso de NaF contenido en la saliva artificial acelera el proceso de corrosión sobre los alambre ortodónticos de NiTi empleados en este estudio.
REFERENCIAS
1. Uribe R, Gonzalo A. Fundamentos de la odontología. Ortodoncia: Teoría y clínica. (2004) corporación para investigadores biológicas. Medellín-Colombia.
2. Ustrell T, Josep M, Duran V. Ortodoncia. (2001). Departamento de odontoestomatología división de ciencias de la salud. Barcelona-España
3. Kenneth J. Anusavice: Phillips. Science of Dental Materials, Saunders 11Ed.(2003)
4. Dunlap CL, Vincent SK, Barker BF. Allergic reaction to orthodontic wire: report of case. J Am Dent Assoc. 1989; 118:449-500.
5. Greppi AL, Smith DC, Woodside DG. Nickel hypersensitivity reactions in orthodontic patients. Univ Tor Dent J. 1989; J3:11-14.
6. Kerosuo H, Moe G, Kleven E. In vitro release of nickel and chromium from different types of simulated orthodontic appliances.AngleOrthod. 1995; 65:2111-116.
7. House K, Sernetz F, Dymock D, Sandy J, Irelende A. Corrosion of orthodontic appliances-should we care?.Amer J of Orthodontics and dentofacialorthopedics. (2008) 133(4) pp 584-592.
8. Weinhold E, Velzaco G. Liberación de iones metálicos en el medio bucal por fenómenos de corrosión de aleaciones. Universidad de los Andes. (2009) Mérida-Venezuela
9. Walker MP, White R, Rula K. Effect of fluoride prophylsctic agents on the mechanical propierties of nickel-titanium based orthodontic wire. J orthoddentofacial. (2005) 78(9)
10. Castro S,Ponces M, Lopes J, VasconcelosM,Pollmann M. Orthodontic wires and its corrosion-The specific case of stainless steel and beta-titanium J. of Dent Sciences (2015) 10(1) pp 1-7.
11. T.P. Chaturvedi, Corrosionbehaviour of orthodonticalloys-a reviewFacultad de Ciencias dentales del Instituto de Ciencias Médicas de la Universidad BanarasHindu, Varanasi
12. Menolasina S. Fundamentos y aplicaciones de electroquimica. Edit. Colección ciencias básicas, serie química. 1° Ed. (2004) Mérida- Venezuela
13. H Strehblow, BTitze, BP Loechel. The breakdown of passivity of iron and nickel by fluoride.CorrosionScience.(1979) 19(7), pp. 1047 -1057
14. Ospino E, Navarro J. Conducta corrosiva de los alambres de Ni-Ti en saliva artificial y enjuagues bucales con fluoruros. Ustasalud (2009)
15. Shiff N, Dalard F, Boinet M, Lissac M, Morgon L, Grosgogeat B. Galvanic corrosion between orthodontic wire and brackerts in fluoride mouthwashe. MedEur J of Orthod. (2006).
16. Lijima M, Yuasa T, Endo K, Mugruma T, OhnoHyMizoguchi I. Corrosion Behavior of ion implanted Nickel - Titanium Orthodontic wire in fluoride mouth rinse solutions. J Dental Materials (2010) 29(1):53-58.
|
 Información General
Información General Artículos
Artículos Notícias
Notícias Enlaces
Enlaces Contactar
Contactar Buscar
Buscar Premio Nadal
Premio Nadal Formación Continuada
Formación Continuada
