| |
MSc. Dubraska Suárez1, Dr. Carlos García2, Dra. Gladys Velazco3, MSc. Anajulia González4, Lic. Néstor Díaz5 1. Profesora en la Universidad de Los Andes. Facultad de Odontología. Departamento de Investigación. Centro de Investigaciones Odontológicas
2. Profesor en la Universidad de Los Andes. Facultad de Odontología. Cátedra de Anatomía Dentaria. Centro de Investigaciones Odontológicas.
3. Profesora en la Universidad de Los Andes. Facultad de Odontología. Cátedra de Materiales Dentales. Centro de Investigaciones Odontológicas.
4. Jefe de Laboratorio. Universidad de Los Andes. Facultad de Odontología. Laboratorio Integrado de Biología Celular y Molecular (LIBCEM).
5. Profesor en la Universidad de Los Andes. Facultad de Odontología. Bioestadística. Facultad de Odontología, Calle 23 entre avenidas 2 y 3, Departamento de Investigación, Universidad de Los Andes (ULA), Mérida-Venezuela. Telef.: 0274-2402379. E-mail: dubraskitasuarez@gmail.com AGRADECIMIENTOS: Al BIOULA bioterio de la Universidad de los Andes, en especial a la MédicoVeterinario Yepsis Montero , A los profesores Justo Bonomie, Gerson Reyes por sus aportes y acompañamiento en el área clínica de Radiología Oral y Maxilofacial.
RESUMEN Los defectos óseos en el macizo cráneo facial son comunes, originando fallas en la reparación del tejido que requieren del empleo de técnicas como la Regeneración Ósea Guiada (ROG). Pero algunas terapias convencionales de ROG producen efectos adversos asociadas al tipo de biomaterial empleado; por ello han surgido tratamientos alternativos, como los andamios a base de quitosano. Se trata de un biomaterial de origen natural, biocompatible, analgésico, antimicrobiano, coagulante, cicatrizante y regenerador óseo. Sin embargo, su efecto como liposoma en la ROG no ha sido estudiado. Objetivo: Evaluar radiográficamente la eficiencia del liposoma a base de quitosano, para la regeneración ósea guiada en ratas Wistar. Metodología: Esta investigación descriptiva, experimental de corte preclínico, fue realizada en 25 ratas Wistar machos, adultas con peso entre 350gr-500gr, provistas por el Bioterio de la Universidad de Los Andes, a los cuales se les creó un defecto longitudinal en ambas tibias(control y experimental). Los animales fueron divididos al azar en 3 grupos: 9 ratas que fueron evaluadas a las 3 semanas, 8 que fueron valoradas a las 6 semanas y 8 para la evaluación a las 9 semanas. Resultados: Radiográficamente, el grupo experimental obtuvo mayor porcentaje de parámetros sugerentes de regeneración ósea en comparación con el control, hallándose diferencias significativas (p=0,001) entre las medias de regeneración ósea entre ambos grupos. Conclusiones: El liposoma de quitosano fue eficiente para la ROG promoviendo mayor regeneración ósea en menor tiempo que en el grupo control. Palabras clave: regeneración ósea guiada, quitosano, ratas Wistar, ensayo preclínico ABSTRACT:
Bone defects in craniofacial skeleton are common, causing failures in tissue repair that require the use of techniques such as Guided Bone Regeneration (GBR). But some GBR conventional therapies produce adverse effects associated with the type of biomaterial used, hence alternative treatments have emerged, such as chitosan-based scaffolds. It is a biomaterial from a natural origin, it is also biocompatible, analgesic, antimicrobial, coagulating and a regenerating bone healer. However, its effect as liposome in the GBR has not yet been studied. Aim: To evaluate radiographically the efficiency of chitosan-based liposome for guided bone regeneration in Wistar rats. Methodology: This preclinical and experimental, descriptive research was performed on 25 adult male Wistar rats between 350grms -500grms, provided by the animal facility of the University of Los Andes. A longitudinal defect in both tibias (control and experimental) was performed in experimentation animals. The rats were randomly assigned to one of 3 groups (one of nine and two of eight subjects) and were assessed at different times (three, six and nine weeks respectively). Results: Radiographically, the experimental group had a higher percentage of suggestive bone regeneration parameters compared to control. Significant differences were found (p = 0.001) for the bone regeneration medium between groups. Conclusions: The liposome of chitosan was efficient in promoting the GBR resulting in greater bone regeneration in a shorter time than the control group.
Keywords: GBR, chitosan, Wistar rats, preclinical research.
INTRODUCCIÓN
En el ser humano la capacidad regenerativa de los tejidos es limitada, por tanto existen daños que superan la habilidad del organismo de restituir el tejido destruido, situación en la cual indiscutiblemente ocurrirá un proceso de reparación, originándose una cicatrización de la herida, más no una regeneración total del tejido. En el hueso de los maxilares, dependiendo del tamaño del defecto, la regeneración autóloga podrá ocurrir a integridad. Pero el reemplazo del defecto por tejido conectivo es una limitación común de la cicatrización de los defectos óseos en los maxilares, ya que interfiere provocando inestabilidad y limitaciones funcionales y anatómicas.1 Esta falla regenerativa, es un evento tan común, que ha despertado el interés de muchos investigadores por idear tratamientos que promuevan la regeneración ósea, cuyo producto sea, un tejido anatómico y funcionalmente idéntico al anterior, es decir, bioingeniería de tejidos 2,3 ; ciencia que plantea el uso de andamios o scaffolds para el crecimiento celular tanto in vitro como in vivo, a base de biomateriales reabsorbibles, ha sido el pilar fundamental de las prácticas regenerativas contempladas en dicha ingeniería de tejidos, pues permiten guiar ese proceso de regeneración, evitando la invasión celular de tejidos diferentes al que se desea reparar, actuando a su vez como una matriz en la cual las células encuentran un lugar para adherirse, proliferar, y especializarse para formar tejido óseo 4. En relación a ello, la regeneración ósea guiada (ROG), actualmente es una de las terapias con gran auge y éxito, pues ha contribuido a solventar alteraciones odontológicas consideradas como un problema de salud pública como los defectos óseos de grandes magnitudes5. La regeneración ósea guiada (ROG) es una terapia basada en el mismo principio de la regeneración tisular guiada, el cual es inducir la regeneración y no la cicatrización de defectos óseos, o mantener el nivel óseo ya existente. Se fundamenta en la utilización de sistemas barrera mediante membranas que aíslan un determinado defecto óseo, excluyendo células provenientes del epitelio gingival y el tejido conectivo en el proceso de cicatrización 6.
A pesar que esta técnica ha sido ampliamente utilizada, aún exhibe limitaciones asociadas a los biomateriales usados, pues no actúan como verdaderos andamios, sino como membranas barreras, pasivas y oclusivas7. Así mismo, la mayoría de las membranas disponibles en el mercado venezolano tienen biocompatibilidad discutible, por provenir principalmente de animales, cadáveres, o son de origen sintético y no reabsorbibles, siendo esta última la que genera peor pronóstico, pues se necesita una segunda cirugía para su retiro, sin mencionar el alto costo que poseen8. Todas estas desventajas indican la necesidad de nuevas propuestas terapéuticas a base de biomateriales de origen natural, debido a la gran similitud biológica, química y física que presentan comparativamente con los tejidos humanos, lo que implica indiscutiblemente una respuesta adecuada del sistema inmune. En este sentido, se ha prestado considerable atención a los materiales basados en quitosano debido a sus múltiples propiedades terapéuticas 9 El quitosano es un biomaterial biocompatible, no tóxico, analgésico y antibacterial con propiedades antivirales y antitumorales, tiene efecto hemostático, cicatrizante de heridas, biodegradable ya que puede ser hidrolizado por lisozimas presentes en los fluidos corporales, como la saliva; actúa como un bioadhesivo 10, ya que al presentar una estructura porosa favorece la integración y vascularización del tejido, tiene una superficie química apropiada para la adhesión, diferenciación y proliferación celular, permitiendo así su unión a las paredes celulares y evitando que sea expulsado fácilmente del defecto óseo, sirve de vehículo para colocar algunos fármacos si se quiere potenciar su efecto 11,12 ; además de ser un biomaterial de fácil obtención y de bajo costo. Todas estas propiedades y ventajas le aportan beneficios apreciables sobre los demás tratamientos, en consecuencia se presenta como la alternativa de tratamiento más completa para ser utilizado en la ROG. En Odontología las aplicaciones clínicas del quitosano usado en forma de membranas, hidrogeles, gelatinas, entre otras, han sido estudiadas en la búsqueda de nuevas propuestas terapéuticas y preventivas 13. Se puede mencionar la restitución de tejidos duros y blandos perdidos, tales como el periodonto, la formación nueva de hueso sano, cemento y orientación de las fibras colágenas periodontales del ligamento en la Regeneración Tisular Guiada (RTG) 14 y la Regeneración Ósea Guiada (ROG), utilizada para cubrir defectos óseos causados por diversas etiologías, tales como: patologías óseas periodontales 14, 15, defectos intraóseos 16. Igualmente se ha estudiado la combinación del quitosano con otras sustancias, por ejemplo: con partículas de Hidroxiapatita (Ha) y Factor de crecimiento fibroblástico 14, o quitosano con plasma rico en plaquetas 15. También se aprecia el uso del quitosano como refuerzo del cemento de fosfato de calcio, utilizado como material de relleno óseo 17 y en la ingeniería de tejidos bucales, como membrana matriz para el cultivo, transporte, fijación y desarrollo de osteoblastos 18.
A pesar de sus múltiples propiedades y amplia aplicación, para el momento de idear esta investigación, se hizo revisión exhaustiva de las publicaciones científicas en diversas bases de datos como: PubMed, LILACS, Medline, Sciencedirect, Scielo, Google Académico, entre otras, y no se encontraron estudios referentes a la aplicación odontológica del quitosano en forma de liposomas usado en conjunto con membrana del mismo principio activo como una forma de tratamiento para la ROG. Sin embargo, existen referencias que apoyan el uso eficaz de este biopolímero como andamio osteoinductor en animales de experimentación 5,16; propiedades que permiten considerarlo como un biomaterial con elevado potencial regenerativo para tratar defectos óseos. En este sentido, el objetivo de esta investigación fue Determinar radiográficamente la eficiencia del Quitosano para la regeneración ósea guida en defectos óseos creados en tibias de ratas del linaje Wistar MATERIALES Y MÉTODOS El presente estudio se clasifica como de tipo confirmatorio, siguiendo la taxonomía de Hurtado19. Correlativamente esta investigación se ajusta al el diseño experimental descrito en la clasificación de Arias 20. Específicamente se trata de un ensayo preclínico in vivo realizado en animales de laboratorio. Muestra.
Estuvo constituida por 25 Ratas de laboratorio machos, del linaje Winstar (Rattus norveguicus albinus), de 4-5 meses de edad, con un peso comprendido entre 300gr-350gr , provistas por el Bioterio de la Universidad de los Andes-Mérida (BIOULA). El grupo experimental estuvo formado por 25 tibias derechas y el control 25 tibias izquierdas. La selección de la muestra estuvo determinada por los criterios éticos establecidos por el bioterio en cuanto al empleo del menor número posible de animales y usando un muestreo por conveniencia ajustado a los criterios anteriormente descritos, por ende la muestra se clasifica como no probabilística20.
La identificación de los animales que conformaron los grupos a evaluar en cada una de las semanas se realizó por marcaje de la cola en aros de diferentes colores para cada grupo, y durante el período experimental, se mantuvieron en jaulas individuales y luego en tres grupos: al grupo de animales a los que se les realizó la primera evaluación (semana 3), el grupo de la segunda evaluación (semana 6) y el de la tercera evaluación (semana 9). Sistema de variables. Los parámetros por medio de los cuales se evaluó este sistema de variables son: Las Variable independiente: El quitosano en forma de liposoma cubierto con membrana de quitosano al momento de su implantación.
La Variable dependiente: representada por la regeneración ósea medida por los Hallazgos Radiográficos. Para la evaluación de esta variable, se determinaron diferentes indicadores para cada una de sus dimensiones. A saber:
a. Hallazgos radiográficos: se tomaron radiografías a los animales de estudio en las semanas 3, 6 y 9 posterior a la cirugía experimental para valorar los siguientes parámetros radiográficos: 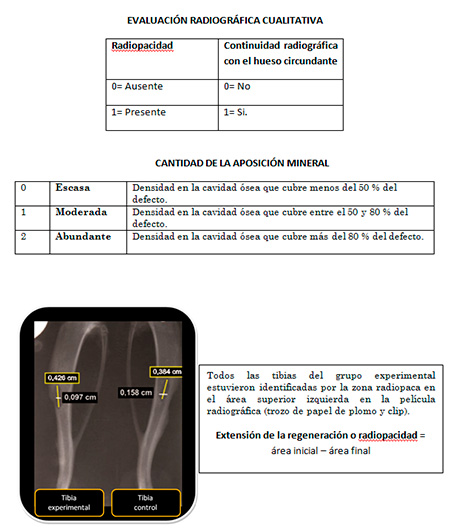 Figura 1. Método de medición del defecto óseo en radiografía de referencia. Fuente propia 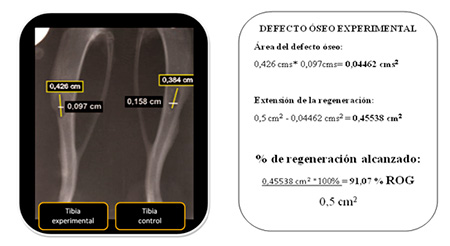 Figura 2. Obtención del porcentaje de ROG de los defectos óseos. Fuente: propia ELABORACIÓN DE LOS LIPOSOMAS DE QUITOSANO.
Para la preparación de los liposomas, se seguirá el procedimiento estandarizado por el Centro de Investigaciones Odontológicas de la Facultad de Odontología de la Universidad de Los Andes. Este consiste en dispersar por técnica de goteo solución ácida de quitosano al 5% en solución de hidróxido de sodio. Posteriormente, se lava con agua destilada y se conservan envasados en tubos de centrífuga con agua destilada; finalmente, se esterilizan con luz ultravioleta.  Figura 3. Obtención de los liposomas de quitosano. Fuente propia
PROCEDIMIENTO.
Los animales fueron intervenidos en grupos de 8 por semana y 9 en la última semana de intervención, de manera sucesiva hasta intervenir a los 25 animales previstos, llevándose a cabo dicha experiencia en un total de 3 semanas de procedimientos quirúrgicos.
Fase Prequirúrgica:
Luego de la organización de las mesas de trabajo con todos los insumos, instrumental y equipos necesarios, se asignaron de forma aleatoria los animales a cada grupo de evaluación 3, 6 y 9 semanas. Se comenzó por el pesaje del animal para el cálculo de las dosis anestésica, analgésica y antibiótica. Luego se administró el anestésico Tiopental (Pentotal®) en dosis de 0,5 ml/kg vía intraperitoneal y una vez sedado se preparó el campo operatorio lavando con solución Betanide® y depilando ambas patas del animal. La frecuencia de la administración de tiopental para la anestesia quirúrgica dependió del tiempo de la intervención en relación al efecto ultracorto de la droga. Sin embrago se procuró realizar la intervención en ambas patas en menor tiempo posible bajo una única dosis anestésica.
Fase Quirúrgica:
Se inmovilizó cada pata trasera comenzando la experiencia por la pata derecha de la wistar o lado experimental. Se aplicó anestesia local intramuscular en el área en dosis de 0,25 ml de Lidocaína (Rapicaine®) al 2% con adrenalina al 1.100.000. Se diseñó el colgajo longitudinal y con una hoja de bisturí No 15, se realizó una incisión de 2 cm longitudinalmente sobre la cara anterior de cada pata, luego se separó la piel y el espacio intramuscular hasta visualizar el músculo cortándolo hasta liberar el hueso. Se cortó el periostio cuidadosamente y se separó de la tibia. Con un micromotor, una fresa cilíndrica 701, se realizó el fresado o desgaste del hueso a baja velocidad en posición totalmente vertical, en refrigeración constante con solución fisiológica y secado con gasa estéril, hasta obtener un defecto óseo lineal de 1cm de longitud y de ancho 0,5 cm, con profundidad de la mitad de la punta activa de la fresa hasta llegar a médula. Se lavó con solución fisiológica y secó con gasa estéril.
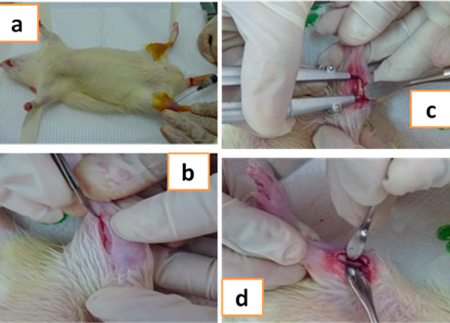
Figura 4. Anestesia (a), incisión (b), realización del defecto (c) e implantación del liposoma de quitosano dentro del mismo (d).
Luego se implantó sobre la pata derecha de uno a dos liposomas de Quitosano, una vez inserto se cubrió con membrana de quitosano para estabilizar el relleno. Se reposicionaron los tejidos cuidando de no movilizar la membrana. El músculo se suturó con técnica continua usando sutura reabsorbible Vicryl® 4-0 y en la piel con sutura no reabsorbible seda negra 3-0 que se retiraba a los 8 días posteriores a la cirugía. 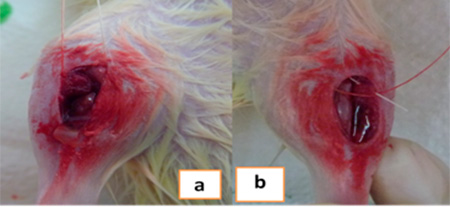 Figura 5. a. Presutura muscular para fijación de la membrana.
b. Sutura de planos muscular y epitelial. Se repitió el mismo procedimiento en la pata izquierda, salvo que no se implantó nada. Inmediatamente terminada la cirugía se le administró analgésico (Meloxicam, 1,0 mg/kg de peso 1 vez al día por 3 días, vía subcutánea) y antibiótico (Lincomicina 0,015 ml suministrado en dosis única, vía intraperitoneal) por vía intramuscular en dosis únicas. Los animales se ubicaron en jaulas individuales, observándolos hasta recuperar conciencia y se trasladaron a un cubículo acondicionado y sólo para este grupo de animales, fueron vigilados y alimentados por el personal técnico del BIOULA.
Fase Post-quirúrgica:
A la tercera, sexta y novena semana se sacrificaron los animales mediante la utilización de sobredosis anestésica intraperitoneal con tiopental. La obtención de las muestras para la valoración radiográfica se realizó mediante disección y cada una de las muestras fue identificada e inmersa en formalina al 10%. 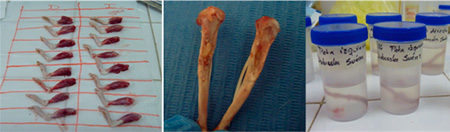
Figura 6. Disección y conservación de las tibias Se llevó a cabo la toma de radiografías colocando la película radiográfica n° 2 sobre un mesón alto, la ubicación del cono en forma vertical, a una distancia focal del previamente estandarizada por medio del bloque de mordida posterior del juego XCP para radiografías periapicales. Se colocaron ambos bloques de tibias (derecha e izquierda) en cada película radiográfica, ubicando el área de defecto hacia arriba. La identificación del lado experimental se logró colocando un clip en la esquena superior izquierda de la película radiográfica. Se revelaron automáticamente y se digitalizaron usando escáner para el llenado del instrumento. Metodología estadística Los datos fueron procesados en el programa informático estadístico SPSS versión 15.0 para Windows. Cada parámetro fue analizado según estadísticos descriptivos básicos, utilizando distribución de frecuencias para las variables categóricas, y estadísticos descriptivos de resumen de datos como medidas de tendencia central (media aritmética) y de dispersión (mínimo, máximo y desviación estándar) para las variables relacionadas con las medidas del defecto óseo y cantidad de hueso neoformado. Adicionalmente previa comprobación del supuesto de normalidad e igualdad de varianzas, se analizaron las medidas radiográficas cuantitativas a través de la prueba T para muestras relacionadas, con un nivel de confianza del 95%, a fin de conocer si existieron diferencias significativas entre las medias de ambos grupos en cada una de las evaluaciones. Para la prueba de significancia estadística, se tomaron en cuenta dos tipos de hipótesis: Ho: El porcentaje promedio de regeneración ósea en el grupo experimental es igual al porcentaje promedio de regeneración ósea en el grupo control. HA: El porcentaje promedio de regeneración ósea en el grupo experimental es diferente al porcentaje promedio de regeneración ósea en el grupo control. El criterio de decisión fue:
Si p_valor es menor o igual al nivel de significación α =0,05 (5% de error), se rechaza la hipótesis nula. En caso contrario (p_valor ≥ α=0,05) no se rechaza la hipótesis nula.
Por otro lado, se aplicó el test no paramétrico de signos de Wilcoxon para muestras relacionadas para verificar si existieron diferencias en las medias de ambos grupos por semanas. Se hizo elección de la prueba de signos de Wilcoxon puesto que el test de Kolmogórov-Smirnov no reveló distribución normal de los datos por semana. RESULTADOS Reducción del área del defecto óseo: El grupo experimental mostró mayor promedio de reducción que el grupo control en todas las semanas de evaluación como se puede apreciar en el gráfico 4. De forma detallada para el grupo experimental la reducción promedio para cada evaluación fue la siguiente: para la semana 3 (primera evaluación), el promedio de reducción de los defectos en el grupo experimental fue de 37,2 mm2. Para la semana 6 (segunda evaluación) resultó en 40,87 mm2. Para la tercera evaluación (semana 9) el promedio de reducción aumentó a 44 mm2. 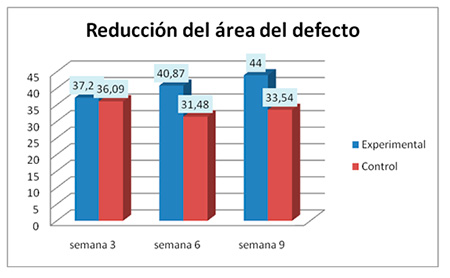 Gráfico 1. Promedio de Reducción de los defectos en cada evaluación para ambos grupos de estudio Porcentaje de regeneración ósea En cuanto a esto, se pudo apreciar una marcada tendencia cada vez más ascendente en el grupo experimental, comenzando en la semana 3 con el 74,43% de regeneración ósea, tendencia que finaliza con el 88% de regeneración ósea para la semana 9. Esta relación es divergente y opuesta con lo que ocurrió en el grupo control, en el que para la semana 3 la frecuencia era muy similar a la del grupo experimental (72.18%) pero luego descendió a la semana 6. Al cabo de la semana 9 en el grupo control se encauzó la tendencia de la regeneración ósea (67,08%) pero dista mucho de la frecuencia observada en el grupo experimental (88%). 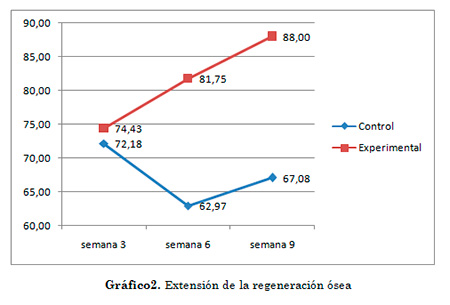
Extensión de la regeneración ósea final en función del área inicial por grupos para todas las evaluaciones (acumulado). En cuanto al promedio de extensión de la regeneración ósea, en el grupo experimental (82%) fue mayor que en el grupo control(67%), confirmando lo observado en todos los hallazgos radiográficos comentados.
Estadísticos de muestras relacionadas
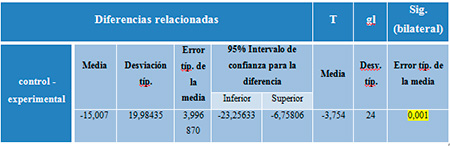
Así mismo, se determinó la diferencia entre los promedios de regeneración ósea en el grupo control y en el grupo experimental. Esto se estimó a través de la prueba T que arrojó un p_valor 0,001, indicativo de que existen diferencias significativas entre las medias de regeneración ósea entre el grupo control y experimental (Tabla 7). Por tanto se acepta la hipótesis alternativa, que establece que existen diferencias significativas entre grupo experimental y control, diferencias observadas en el análisis descriptivo de las variables y que indicaban mayor porcentaje de regeneración ósea en el grupo experimental.
Tabla 1. Prueba T. Diferencia acumulada de medias muestras relacionadas entre grupos al final del estudio.
Por otro lado, por semanas la distribución de los datos no es normal, por tanto, el comportamiento semanal del porcentaje de ROG en ambos grupos, se verificó con el test no paramétrico de signos de Wilcoxon para muestras relacionadas como alternativa a la prueba T, estableciendo el nivel de significancia se estableció en 0,05. Tabla2. Prueba de los rangos con signo de Wilcoxon (prueba no paramétrica de diferencia de medias) 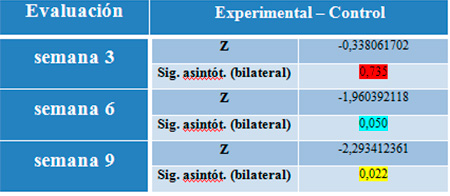 Se aprecia que el grupo experimental obtuvo mayor regeneración ósea en menor tiempo que el control (Hi= μC≠μE = <0,05). Al observar el p_valor en la semana 3 correspondiente a 0,735, por ser mayor que 0,05, no existen diferencias significativas entre las medias de ROG del grupo experimental y control.En la semana 6, el p_valor se ubica en 0,050, y como representa el punto de corte la prueba no es concluyente en cuanto a si existen o no diferencias entre ambos grupos. En la semana 9 si se observaron diferencias significativas entre grupo experimental y control, pues p_valor fue 0,022, indicando que sí se obtuvo mayor porcentaje de regeneración ósea en el grupo experimental, a la novena semana posterior a la implantación del liposoma de quitosano. DISCUSIÓN El obtener mayor porcentaje de regeneración ósea en el grupo experimental y el comportamiento del tejido ante el andamio liposomal de quitosano son resultados que pueden explicarse por la rapidez con que se diferencian mayor número de células en la estirpe osteoblástica y su crecimiento más acelerado en presencia de quitosano, rico en glucosaminoglicano, extrapolable a la inducción que producen los glucosaminoglicanos nativos que se encuentra intracelularmente en mastocitos del tejido conectivo y otras células hematopoyéticas, participando en la respuesta inmune e inflamatoria. También el quitosano pudo haber tenido actuación a nivel de la matriz extracelular como sucede con los proteoglicanos (PG) propios del cuerpo, los cuales participan principalmente en procesos de difusión de moléculas hidrosolubles, migración, proliferación y adhesión celular. Estos PG participan en interacciones célula-matriz extracelular, adhesión célula-célula y señalización celular. La bioestimulación celular asociada al quitosano y su grupo funcional es un evento que ya había sido indicado por Suphasiriroj y cols. (2008)21 y Akman y cols. en el año 201014 cuando lograron medir este efecto en cultivos celulares. En torno a la explicación de esta respuesta, autores como Venkatesan y Kim 201022, afirman que el quitosano por sí mismo no es osteoconductivo pero al interactuar con la hidroxiapatita (presente en el medio óseo formando parte de la fase inorgánica del hueso y que es sintetizada para la reparación del defecto) mejora tal propiedad y por lo tanto el biomaterial es capaz de comportarse similar al hueso natural. Toda la evidencia proporcionada por las pruebas inferenciales permiten comprobar la tendencia observada en el análisis descriptivo de los datos radiográficos: las tibias tratadas con quitosano mostraron mayor porcentaje de ROG al finalizar el estudio que las tibias no tratadas. Esto concuerda con lo expresado por Danilchenko y col. 201123, quienes concluyen que los andamios de quitosano demostraron buenas propiedades osteoinductivas y que dichos andamios pueden usarse como sustitutos de tejido óseo. Sin embargo, es necesario diferir un poco de la opinión de estos autores pues el biomaterial no es un sustituto, más si constituye una matriz para rellenar provisionalmente el defecto y aminorar la tensión mecánica que el defecto óseo ocasiona en el área circundante al él, porque en condiciones de disolución de continuidad, el hueso es frágil y tardará en formar un tejido fibroelástico provisional para promover su reparación y con ello reponer su funcionalidad.
CONCLUSIONES Y RECOMENDACIONES
El uso del liposomas de Quitosano en defectos óseos en tibias de ratas Wistar como andamios para la ROG promueve la neoformación ósea en menor tiempo que el tiempo que tarda en regenerar un defecto en condiciones fisiológicas naturales, por lo tanto es eficiente para la ROG. Radiográficamente tanto a las 3, y 9 semanas de evaluación desde el punto de vista cualitativo el liposoma de quitosano tuvo mayor eficiencia para la ROG en los defectos óseos. Del análisis radiográfico cuantitativo, se infiere que el liposoma de quitosano promovió mayor porcentaje de extensión de la ROG en cada una de las semanas de evaluación, manteniendo una tendencia creciente en el tiempo con porcentajes cercanos al 100% para la última semana de evaluación. El análisis estadístico inferencial de los datos permitió evidenciar que existen diferencias estadísticamente significativas entre la cantidad de ROG obtenida en el grupo control y experimental, siendo mayor en el grupo tratado con liposoma de quitosano.
Se recomienda:
Ejecutar el mismo estudio por un período de evaluación más largo, para observar cuánto tiempo tarda en reabsorberse por completo el quitosano en este modelo animal, y cuánto tardará en lograrse en su totalidad la regeneración de los defectos óseos tratados y no tratados.
Aumentar el tamaño muestral de los animales de experimentación para hacer más evidentes las diferencias intra e intersemanales entre los grupos control y experimental Reproducir el estudio en defectos óseos maxilares, en el área de cirugía bucal, pues una vez corroborada su biocompatibilidad y eficacia para ROG en animales de experimentación puede valorarse la utilidad del biomaterial en seres humanos.
REFERENCIAS BIBLIOGRÁFICAS
1. de la Rosa M, Cepeda J. Regeneración ósea guiada de cara al año 2000. Consideraciones clínicas y biológicas. Rev ADM 2000; 57(4): 147-53.
2. Estrada C, Paz A, López L. Ingeniería de tejido óseo: consideraciones básicas. Rev EIA. 2006; 5: 93-100
3. Hardingham, T; Tew, S y Murdoch, A. Tissue engineering : chondrocytes and cartilage. Arthritis Res 2002;4 (Suppl 3):S63-S68.
4. Agrawal C, Ray R. Biodegradable polymeric scaffolds for musculoskeletal tissue engineering. J Biomed Mater Res. 2001; 55(2): 141-50.
5. Campo, M; Contreras, C. . Efectividad de membranas de quitosano con y sin hidroxiapatita para la regeneración ósea guiada. [Tesis]. Facultad de Odontología-Universidad de los Andes. Mérida-Venezuela; 2011.
6. Simion M, Fontana F, Rasperini G, Maiorana C. Vertical ridge augmentation by expanded-polytetrafluoroethylene membrane and a combination of intraoral autogenous bone graft and deproteinized anorganic bovine bone (Bio Oss). Clin Oral Implants Res. 2007; 18(5): 620-9.
7. Suárez D, García C, Yépez J, González A, Velazco G. Regeneración Osteomucosa con Membrana de Quitosano: Reporte de un Caso. [revista en internet]REDOE. 2011. [Citado el 26 de Julio de 2011]. Disponible en:
8. Simion M, Baldoni M, Rossi P, Zaffe D. A comparative study of the effectiveness of e-PTFE membranes with and without early exposure during the healing period. Int J Periodontics Restorative Dent. 1994; 14(2): 166-80.
9. Harish,K., Tharanathan,R. Chitin/chitosan: modifications and their unlimited application potential-an overview. Trends in Food Science & Technology. March 2007. 18 (3): 117-131.
10. Jorquera R, Jorquera O, Rivera S. Quitosano: Un material con Propiedades regenerativas y su Aplicación Clínica [internet]. REDOE. 2008 [Citado el 10 de Julio de 2010]. Disponible en: http://www.redoe.com/ver.php?id=100
11. Lárez C. Quitina y Quitosano: Materiales del pasado para el presente y el futuro. Rev Avances en Química. 2006;1(2):15-21
12. Lárez C. Algunos Usos del Quitosano en Sistemas Acuosos. Rev Iberoamericana de Polímeros. 2003;4(2):91-109
13. Veiga M, Ruiz R. El Quitosano: Usos farmacéuticos y biológicos. Rev OFIL. 2004;14(2):33-42
14. Akman A, Tığlı R, Gümüşderelioğlu M, Nohutcu R. bFGF-loaded HA-chitosan: A promising scaffold for periodontal tissue engineering. J Biomed Mater Res Part A. 2010;92A(3):953-962
15. Yufeng Z, Yining W, Bin S, Xiangrong C. A platelet-derived growth factor releasing chitosan/coral composite scaffold for periodontal tissue engineering [Resumen]. Biomaterials. 2007; 28(8): 1515-1522.
16. Park J, Choi S, Moon I, Cho K, Chai J, Kim C. Eight-week histological analysis on the effect of chitosan on surgically created one-wall intrabony defects in beagle dogs [Resumen]. J Clin Periodontol. 2003;30(5):443-453
17. Moreau J, Xu H. Mesenchymal stem cell proliferation and differentiation on an injectable calcium phosphate-chitosan composite scaffold. Biomaterials. 2009;30(14):2675-2682
18. Larena A, Cáceres A, De la Piedra C, Montero M, Vicario C, Fuentes A, Ibarzábal A, Bernabeu E, Ribelles P. Preparación de biomateriales basados en quitosano y estudios como portadores de osteoblastos en cultivo. Patología del Aparato Locomotor de la Fundación Mapfre Medicina. 2005;3(1):55-63
19. Hurtado, J (2000). Metodología de la Investigación Holística. Tercera edición. Editorial Fundación Sypal, Caracas, Venezuela pp 453-455, 523-529
20. Arias F. El proyecto de Investigación. Introducción a la metodología científica. 5ta ed. Caracas, Venezuela: Episteme; 2006
21. Suphasiriroj W, Yotnuengnit P, Surarit R, Pichyangkura R. The fundamental parameters of chitosan in polymer scaffolds affecting osteoblasts (MC3T3-E1) [resumen]. J Mater Sci: Mater Med. 2008;1(20):209-320
22. Venkatesan, J y Kim, S.Chitosan composites for bone tissue engineering-an overview.Mar.Drugs. 2010; 8: 2252-2266.
23. Danilchenko, S., Kalinkevich, O.,Pogorelov, M., Kalinkevich, A., Sklyar, A., Kalinichenko, T., Ilyashenko, V., Starikov, V.,Bumeyster, V., Sikora, V y Sukhodub, L. Characterization and in vivo evaluation of chitosan-hydroxyapatite bone scaffolds made by one step coprecipitation method. J Biomed Mater Res A. 2011 Mar 15; 96(4):639-47. doi: 10.1002/jbm.a.33017. Epub 2011 Jan 25.
|
 Información General
Información General Artículos
Artículos Notícias
Notícias Enlaces
Enlaces Contactar
Contactar Buscar
Buscar Premio Nadal
Premio Nadal Formación Continuada
Formación Continuada
