| |
José Araujo1, Eglee Negrón1, Gladys Velasco1, Dubraska Suárez1, Anajulia González1, Rosalba Florido6, Blanca Rojas de Gascue 1. Centro de Investigaciones Odontológicas. Facultad de Odontología Universidad de Los Andes. Mérida, Venezuela.
2. Cátedra de Anatomía Patológica de la Facultad de Odontología de la Universidad de Los Andes, Mérida - Venezuela.
3. Departamento de Biomedicina. Universidad de Oriente, Cumana, Venezuela. Correspondencia: Dra. Gladys Velazco, Cátedra de Odontología Social, Departamento de Odontología Preventiva y Social, Facultad de Odontología, Universidad de Los Andes, Casona La Sierra Primer Piso, Calle 23, entre Avenidas 2 y 3, Boulevard de los Pintores, Mérida (5101), Venezuela. Tel/Fax. 00(58) 274-2402382. E-mail:gvelazco@ula.ve Resumen: La osteítis alveolar es una patología infecto-inflamatoria conocida como la complicación post-quirúrgica más común, que produce un intenso dolor. Las terapias convencionales en ocasiones producen efectos adversos; por ello han surgido tratamientos alternativos, como los biomateriales. El quitosano, es un biomaterial de origen natural, biocompatible, analgésico, antimicrobiano, coagulante, cicatrizante y regenerador óseo. Sin embargo, su efecto en la osteítis alveolar no ha sido estudiado. Por estas razones, se perfila como una alternativa terapéutica para esta patología. Objetivo: Comparar la eficiencia del xerogel y liposoma a base de quitosano, para la remisión de la osteítis alveolar en ratas Wistar. Metodología: Este estudio experimental preclínico descriptivo, fue realizado en 15 ratas Wistar machos, adultas con peso entre 300gr-350gr, provistas por el Bioterio de la Universidad de Los Andes (BIOULA), a los cuales se les extrajo el incisivo superior derecho y se indujo la osteítis alveolar. Los animales fueron divididos al azar en tres grupos: 5 ratas para el grupo control, 5 ratas para el grupo A tratadas con xerogel y 5 ratas para el grupo B con liposoma. Estos grupos fueron evaluados histológicamente a los 7 y 14 días. Resultados: Los hallazgos histológicos determinaron que la regeneración del alvéolo es semejante con el liposoma y el xerogel, a diferencia de que con el xerogel, las zonas osteoides se observaron más densas que con el liposoma. Conclusiones: tanto el liposoma como el xerogel a base de quitosano representan una excelente terapéutica para la osteítis alveolar en ratas Wistar, siendo más eficiente el liposoma. Palabras clave:Osteítis Alveolar, Quitosano, Xerogel, Liposoma, Biomateriales, Reparación.
Introducción.
En el ejercicio diario de la odontología, los pacientes acuden a consulta cuando sus estructuras dentarias padecen afecciones severas que sólo se resuelven con la exodoncia, lo que convierte a las extracciones dentarias en procedimientos quirúrgicos de práctica rutinaria.(1)En este procedimiento clínico se pueden presentar diversos tipos de complicaciones como la osteítis alveolar. La osteítis alveolar es una patología infecto-inflamatoria, reversible y localizada de forma superficial que aparece de 2 a 4 días después de una extracción dentaria(2), como consecuencia de una perturbación en la cicatrización de la herida alveolar(3). Es un estado necrótico del proceso alveolar, que debido a la ausencia de vasos sanguíneos no permite la proliferación de capilares, ni de tejido de granulación para organizar el coágulo sanguíneo, produciendo un dolor tan intenso que se considera una urgencia odontológica(2,4). Es la complicación post-extracción más común, su frecuencia varía entre el 1 y 4%(2) pudiendo alcanzar el 68,4% en extracciones de terceros molares mandibulares impactados(3), y es más frecuente en el sexo femenino y en la tercera y cuarta década de la vida(2,3,5,6). Esta patología ha sido asumida con tratamientos locales y sistémicos convencionales. Dentro de las opciones para el tratamiento vía local se encuentran: el uso de anestésicos locales con vasoconstricción(2), irrigaciones intraalveolares con solución fisiológica o agua destilada(2,5,6); curetaje del alvéolo(2,5,7) o la colocación de Alvogyl®(8-10). De la misma manera, tenemos los tratamientos de la vía sistémica como el uso de analgésicos, barbitúricos, antiinflamatorios y antibioticoterapia pre y post extracción(2,3,6,11-13). Sin embargo estos tratamientos pueden generar diversas complicaciones, tales como reacciones de hipersensibilidad a los anestésicos, antibióticos y/o AINEs, el legrado del alvéolo puede diseminar la infección retardando la cicatrización, además de que si se realiza con mucha fuerza se puede producir una comunicación bucosinusal, en el caso de alvéolos postero-superiores. Igualmente, la colocación de materiales dentro del alvéolo como es el caso de tapón gelita, Alvogyl®, gasa iodoformaday otros, ha caído en desuso, ya que se pueden desalojar fácilmente del alvéolo o el organismo puede rechazarlos por ser cuerpos extraños(2,3,5,7,10,14,15). Y por último, el uso de la clorhexidina puede pigmentar de color marrón los dientes, algunos materiales de restauración y el dorso de la lengua, además del sabor amargo que produce(12). El tercer grupo lo conforman los tratamientos de la vía alternativa, con tratamientos poco convencionales, como LÁSERMED (láser terapéutico de arseniuro de galio aluminio)(3), los rayos ultravioleta(2,10); el ultrasonido(2,3,10); la electroterapia que ha reportado que puede causar hiperemia cutánea y quemaduras(2); magnetoterapia(15); ozonoterapia(2,16); acupuntura (2,3,10,15,17) y uso del soft-laser(3), el cual es uno de los tratamientos más efectivos, pero presenta un alto costo, dificultando su adquisición para el paciente. Dentro de este grupo, tenemos también las terapias donde lo natural prevalece, por ejemplo los tratamientos homeopáticos como coadyuvantes con flores de Bach(18); apifármacos(6,19); oxígeno hiperbárico(3,10); y el extracto acuoso de aloe vera(4). El quitosano es un polisacárido proveniente de la quitina, la cual se conoce como el segundo polisacárido más abundante del planeta, después de la celulosa (materia base del papel)(20,21), que se encuentra comúnmente en la naturaleza tanto en el reino animal en el exoesqueleto de muchos crustáceos, alas de insectos (escarabajos, cucarachas) y en el reino vegetal (paredes celulares de hongos, algas, entre otros). Es un biomaterial biocompatible, no tóxico, conuna dosis toxica reportada de 16g/Kg en las ratas de laboratorio, es decir, su toxicidad es cercana a la de la sal y el azúcar.(22)Presenta propiedades analgésica y antibacterial, antivirales y antitumorales, tiene efecto hemostático, cicatrizante de heridas, biodegradable ya que puede ser hidrolizado por lisozimas presentes en los fluidos corporales, como la saliva y además actúa como un bioadhesivo(20), ya que al presentar una estructura porosa favorece la integración y vascularización del tejido, tiene una superficie química apropiada para la adhesión, diferenciación y proliferación celular, permitiendo así su unión a las paredes celulares, además es un biomaterial de fácil obtención y bajo costo. Las aplicaciones clínicas odontológicas del quitosano usado en forma de membranas, hidrogeles, gelatinas, entre otras, han sido estudiadas en la búsqueda de nuevas propuestas terapéuticas y preventivas(23), se puede mencionar la restitución de tejidos duros y blandos perdidos, tales como el periodonto, la formación nueva de hueso sano, cemento y orientación de las fibras colágenas periodontales del ligamento en la Regeneración Tisular Guiada (RTG)(24) y la Regeneración Ósea Guiada (ROG), utilizada para cubrir defectos óseos causados por diversas etiologías, tales como: patologías óseas periodontales(24,25), defectos intraóseos(26), entre otros. Todas estas propiedades le aportan ventajas apreciables sobre los demás tratamientos para la osteítis alveolar, en consecuencia se presenta como la alternativa de tratamiento más completa para esta afección odontológica. Es por esto, que el objetivo de este estudio consistió en comparar la eficiencia del xerogel y liposoma a base de quitosano, como propuestas terapéuticas alternativas para la remisión de la osteítis alveolar en ratas Wistar. Metodología.
Este estudio descriptivo de diseño experimental preclínico, fue realizado con una muestra de 15 ratas macho adultas sanas, de la cepa Wistar (Rattus norveguicus albinus), con un peso promedio comprendido entre 350 a 400grs, provistas por el Bioterio de la Universidad de Los Andes (BIOULA).Los animales fueron divididos al azar en tres grupos: 5 ratas para el grupo control (que no recibieron tratamiento), 5 ratas para el grupo A tratadas con xerogel y 5 ratas para el grupo B tratado con liposoma, en las cuales se presentaba la patología. Estos grupos fueron evaluados histológicamente a los 7 y 14 días posteriores a la aparición de la osteítis alveolar, para identificar cuál fue el grupo con mayor remisión de la patología en el menor tiempo registrado. Los materiales utilizados comprendieron:
• El xerogel de quitosano, elaborado por el Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas (IIBCA) de la Universidad Simón Bolívar (Caracas-Venezuela).
• El liposoma de quitosano, manufacturadas en el Laboratorio de Biología Celular y Molecular de la Facultad de Odontología de la Universidad de Los Andes (Mérida-Venezuela).
• Puntas de papel estériles.
• Adrenalina (1:1000).
• Solución Ringer.
• Formalina.
• Sutura reabsorbible 4-0.
• Películas radiográficas Nº 2.
• Algodón.
• Gasa.
• Jeringas de insulina debidamente identificadas con el nombre de su contenido.
• Ketamina y Silacina.
• Lidocaína.
• Ratarina (Protinal®).
• Meloxicam. El instrumental que se utilizó de acuerdo a cada procedimiento fue:
• Hojas de bisturí nº 11 y mango de bisturí nº 3 para la sindesmotomía.
• Espátula 7ª, luxación de la pieza.
• Pinzas mosquito para extracción propiamente dicha de la pieza.
• Lima endodóntica y regla milimetrada para la medición del alvéolo.
• Un portadycal para la colocación del xerogel y liposoma intra-alveolar. Los Equipos utilizados fueron:
• Equipo de rayos X intraoral: toma de radiografías.
• Cámara fotográfica semi-profesional marca SONY modelo DSC-H20, de 10 megapíxeles y Cámara fotográfica profesional CANON 3D de 8 megapíxeles con objetivo macro 100x., una mesa para fotografías y un negatoscopio para el registro fotográfico de los hallazgos clínicos, radiografías, preparados histológicos y video del procedimiento. En esta investigación se tomaron en cuenta 4 tipos de variables; una variable dependiente (osteítis alveolar), una independiente (quitosano), una variable interviniente (Tiempo, representado en días de estudio) y una variable extraña (tipo de alveolitis que se presentó)(27). La variable dependiente fue evaluada a través de los parámetros expuestos en las tablas 1 y 2. Dimensión Histológica*.
Formación de Tejido Conjuntivo • Ausente
• Escaso.
• Moderado
• Elevado
Vasos Sanguíneos. • Ausente.
• Escaso.
• Moderado.
• Elevado.
Neutrófilos (Infiltrado inflamatorio agudo). • Ausente (0 células por campo de alto poder)
• Escaso (0-5 células por campo de alto poder).
• Moderado (6-10 células por campo de poder).
• Elevado (más de 10 células por campo de poder).
Macrófagos, Linfocitos y Plasmocitos (Infiltrado inflamatorio crónico). • Ausente (0 células por campo de alto poder).
• Escaso (0-5 células por campo de alto poder).
• Moderado (6-10 células por campo de poder).
• Elevado (más de 10 células por campo de poder).
Tejido de Granulación • Ausente.
• Escaso.
• Moderado.
• Elevado.
Zonas de Formación Osteoide. • Ausente.
• Escaso.
• Moderado.
• Elevado.
Focos de Mineralización de Zonas Osteoides. • Ausente.
• Escaso.
• Moderado.
• Elevado.
Hueso Maduro • Ausente.
• Escaso.
• Moderado.
• Elevado.
*Debido a la falta de estudios que estipulen la cuantificación celular en ratas Wistar, de los criterios presentes, el histopatólogo, genera sus resultados en comparación con el preparado histológico que mayor número de células se observe.
Por lo tanto la mayor concentración celular fue estandarizada como un 100% y definida como "Elevado", "Moderado" corresponderá al 50% y "Leve" 25%).
Tabla 1. Dimensión Histológica y sus respectivos indicadores. Dimensión Histológica. Nivel de Regeneración Ósea.(28)
Nivel de Regeneración Ósea.(28) • Nivel I (25%): Predominio de tejido de granulación y presencia de infiltrado inflamatorio.
• Nivel II (50%): Presencia de tejido de granulación, presencia de osteoblastos y zonas de formación de osteoide.
• Nivel III (75%): Predominio de osteoblastos, osteoide llena gran parte del defecto creado, focos de mineralización del osteoide (trabéculas osiformes).
• Nivel IV (100%): Mineralización de osteoide en el defecto, presencia de hueso maduro.
Tabla 2. Dimensión Histológica. Nivel de Regeneración Ósea. El estudio fue llevado a cabo en tres (3) etapas: Etapa #1: Selección del modelo animal a utilizar en esta investigación y estandarización de la técnica quirúrgica de la extracción del incisivo central superior derecho y de la inducción de la alveolitis a través de una prueba piloto realizada en 5 ratas Wistar, partiendo del protocolo establecido por Dias J y cols. en su trabajo titulado "Influencia de la tetraciclina local en la microbiota de la osteítis alveolar en ratas"(29), modelo del cual derivaron modificaciones propias del experimento realizado por los autores de esta investigación, para asegurarse de la malformación o ausencia del coágulo en el alvéolo y determinar el lapso de tiempo que tardaron los animales en desarrollar la osteítis alveolar y en remitirla. El proceso de inducción de la osteítis alveolar consistió en,posterior a la extracción dentaria y la medición del alvéolo con una lima endodóntica Nº 20 (ver figura 1A),introducir en el alvéolo una punta de papel endodóntica estéril #80 embebida previamente en Adrenalina (1:1000) y adicionalmente se llenó el alvéolo con 0,1ml de esta misma solución, con una jeringa de insulina durante un (1) minuto y treinta (30) segundos,(ver figura 1B) para obtener una vasoconstricción, que evitara la correcta formación del coágulo sanguíneo, signo clínico característico de la osteítis alveolar. Seguidamente, se realizó la irrigación del alvéolo, con una jeringa de insulina cargada con 0,2ml de solución Ringer, durante treinta (30) segundos, (ver figura 1C)para limpiar y eliminar cualquier detritus y posible coágulo que haya quedado dentro del alvéolo. Posteriormente se realizó la succión intraalveolar con una jeringa y se utilizaron puntas de papelendodónticas estériles, para secar bien la zona y asegurarse del vacío del alvéolo y la ausencia del coágulo. 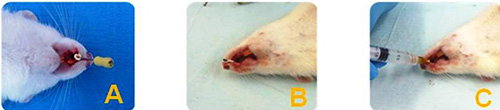 Figura 1. Etapa #1 del Estudio. Proceso de Inducción de la Osteítis Alveolar. (A)Medición del Alvéolo con lima endodóntica Nº 20. (B)Colocación de la punta de papel embebida en adrenalina 1:1000 y llenado del alvéolo con 0,1ml de dicha solución. (C)Irrigación del alvéolo con 0,2ml de solución Ringer.
Etapa #2: Realización del ensayo preclínico, que corresponde a la exodoncia del incisivo superior derecho (ver figura 2)e inducción de la osteítis alveolar en quince (15) ratas Wistar, mediante los procedimientos y técnicas estandarizadas en la primera etapa. Todos estos pasos produjeron en el alvéolo, condiciones semejantes a las observadas en la osteítis alveolar a partir del tercer día posterior a la cirugía y maniobra de inducción de la patología, confirmando la instauración de la misma en los animales del estudio. 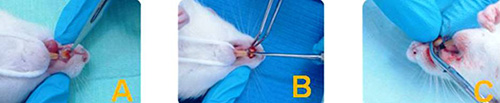 Figura 2. Etapa #2 del estudio. Proceso de exodoncia del incisivo superior derecho (A)Sindesmotomía con punta de bisturí Nº 11 (B)Luxación de la pieza con espátula 7ª (C)Extracción propiamente dicha con pinza mosquito. Una vez instaurada la patología, los animales fueron separados al azar en tres (3) grupos (A, B y C) para la aplicación del tratamiento con el xerogel (Grupo A) y liposoma (Grupo B) a base de quitosano, y la conformación de un grupo control (Grupo C). La colocación del biomaterial se realizó mediante la suave introducción de un portadycal en el alvéolo, para estimular muy levemente el sangrado de la zona y así al introducir dicho biomaterial (xerogel o liposoma a base de quitosano), éste absorba líquido y aumente de tamaño permitiendo el sellado de la herida alveolar.(Ver Figura 3) 
Figura 3. Colocación intraalveolar del xerogel y liposoma de quitosano. (A)Colocación intraalveolar del Xerogel. (B)Colocación intraalveolar del Liposoma Posteriormente se realizaron las evaluaciones histológicas, para lo cual fue necesario hacer la eutanasia de los ejemplares biológicos utilizando una sobredosis de Enflurano USP inhalado, tomando la mitad de cada grupo (2 ratas de los grupos A, B y C) a los 7 días y los ejemplares restantes a los 14 días; para luego realizar la disección del maxilar superior y dejar identificada cada una de las muestras para sus respectivos análisis. Etapa #3: se realizó del análisis de los datos obtenidos a través de los hallazgos histológicos (niveles de cicatrización) con el vaciado y procesamiento de los mismos en el software SPSS v15.0 para efectuar el análisis estadístico de estos y comparar los resultados. Resultados y Discusión. Para realizar la evaluación de los hallazgos histológicos, se tomaron en cuenta los estudios de Rodrigues M, y cols. 2011(30) y Silva M, y cols. 2010(31) quienes establecieron los siguientes criterios:
• Formación de tejido conjuntivo
• Formación de vasos sanguíneos
• Neutrófilos.
• Macrófagos, linfocitos y plasmocitos
• Tejido de granulación
• Zonas de formación osteoide
• Focos de mineralización de zonas osteoides y Hueso maduro. 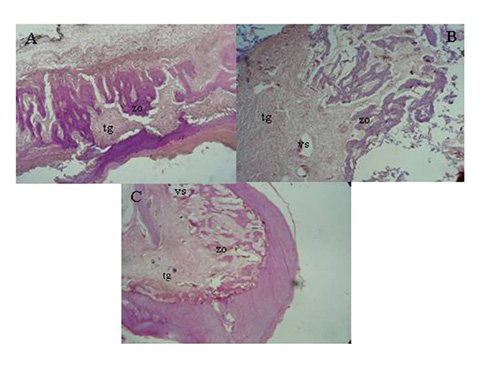 Figura 4. Preparados histológicos donde se observan; (zo)zonas de formación osteoide, (tg)tejido de granulación y (vs)formación de nuevos vasos sanguíneos en los alvéolos tratados con (A)xerogel (B)liposoma y (C)control. Figura 4. Preparados histológicos donde se observan; (zo)zonas de formación osteoide, (tg)tejido de granulación y (vs)formación de nuevos vasos sanguíneos en los alvéolos tratados con (A)xerogel (B)liposoma y (C)control.
Es importante resaltar que la evaluación histológica, fue realizada por la Dra. Rosalba Florido (Anatomo-Patólogo, Profesora de Anatomía Patológica de la Facultad de Odontología de la Universidad de Los Andes-Mérida) y para medir los niveles de cada uno de los indicadores, utilizó el siguiente criterio: primero seleccionó la muestra más representativa, para luego compararla con todos los preparados. Y poder establecer que la muestra con mayor proporción determinada representa el 100% y éste indicador se denominó "elevado", el 50%, de esa mayor proporción correspondió a "moderado" y el 25% o menos se estableció como "leve".
Formación de tejido conjuntivo. En la primera evaluación del 7mo día, se observó un mayor porcentaje de formación de tejido conjuntivo, en los animales del grupo liposoma, ya que presentó una rata caso moderado y una rata con caso elevado. Y los resultados del grupo control fueron: 2 animales con nivel moderado de formación de éste tejido. En la segunda evaluación correspondiente al 14to día, se encontró que la totalidad de la muestra estudiada, presentó un nivel moderado de formación de tejido conjuntivo. (Figura 5). Figura5. Formación de Tejido Conjunto a los 7 y 14 días, en los animales del estudio 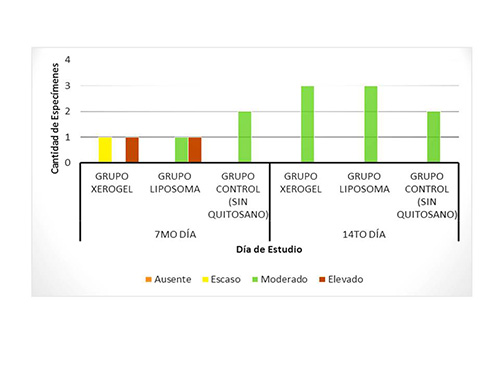 El tejido conectivo, se encontró aumentado en los grupos experimentales tratados con ambas presentaciones de quitosano, lo cual sugiere que se aceleró la diferenciación de los diversos tipos de células, presentes en el organismo favoreciendo la cicatrización, mayormente en el grupo del liposoma, seguido por el grupo del xerogel. Estos resultados son semejantes a los descritos por Knapczyr (1994)(32), Fwu-long y cols. (2001)(33), Lárez (2003)(34), Senel y cols. (2004)(35) y Jorguera y cols. (2008)(20), quienes estudiaron las propiedades regenerativas y bioadhesivas del quitosano en diferentes presentaciones, obteniendo resultados positivos que confirman el uso de este biomaterial, como apósito de heridas, contribuyente del proceso de curación de heridas más acelerado y organizado. Formación de Vasos Sanguíneos. Durante la primera evaluación correspondiente al día 7, la cantidad de vasos sanguíneos fue mayor en el grupo liposoma (una rata con cantidad moderada y una con cantidad elevada), seguido por el grupo control (2 animales en nivel moderado) y en último lugar el grupo xerogel (una rata en nivel escaso y una en nivel moderado). Para la evaluación del 14to día, los resultados se observaron opuestos, ya que la mayor cantidad de vasos se observó en el grupo control (2 ratas en nivel moderado y 1 en nivel elevado), seguido por el grupo del liposoma y el grupo del xerogel, que presentaron los mismos hallazgos (2 animales en el nivel moderado y 1 en escaso para cada grupo experimental) (Figura6) En los resultados de la primera evaluación, se demostró que la mayor cantidad de capilares sanguíneos se desarrolló en el grupo del liposoma y en la segunda evaluación en el grupo control. Esto puede atribuirse a la presencia intraalveolar del biomaterial, la bioadhesividad y la velocidad de biodegradación del mismo. Se presume que la presencia del liposoma, acelera la migración de capilares sanguíneos ya que al biodegradarse libera moléculas que activa la migración de células necesarias para la formación del coágulo de sangre y del tejido de granulación. Figura6. Formación de Vasos Sanguíneos a los 7 y 14 días, en los animales del estudio 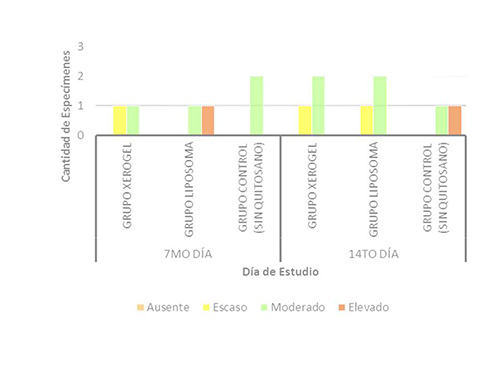 Estos resultados pueden ser comparados con los de Shen y cols. (2005)(36), quienes estudiaron el efecto hemostático del quitosano, llegando a la conclusión que la utilización de este biomaterial como sustito de la trombina acelera la formación de coágulo sanguíneo. Resultados similares a los de Malette y cols. (1983)(37), Rao y Sharma (1997)(38) y Hoekstra y cols. (1998)(39). Presencia de Neutrófilos (Infiltrado inflamatorio agudo). En las evaluaciones realizadas correspondientes al 7mo y 14to día, no se observó la presencia de neutrófilos, los cuales corresponden al infiltrado inflamatorio agudo. Esto se debe a que éstas células, a los 7 días, ya han sido sustituidas por las células pertenecientes al infiltrado inflamatorio crónico, es decir macrófagos, linfocitos y plasmocitos. Presencia de Macrófagos, linfocitos y plasmocitos. En la primera evaluación la presencia de estas células mononucleares, observada fue mayor en el grupo de xerogel (2 ratas en el nivel elevado), seguida por el grupo del liposoma (2 animales en el nivel moderado) y en última instancia el grupo control (1 animal con presencia escasa y 1 con presencia moderada). Para la segunda evaluación correspondiente al día 14, la presencia de estas células tuvieron un descenso, ubicándose en las siguientes categorías: en el grupo xerogel, 1 rata con nivel elevado y 1 rata con nivel escaso y el grupo liposoma 2 ratas con nivel escaso. Este indicador no fue observado en una rata del grupo xerogel, una rata del grupo liposoma y en las dos ratas del grupo control (Figura 7) Figura7. Presencia de Infiltrado Inflamatorio Crónico a los 7 y 14 días, en los animales del estudio. 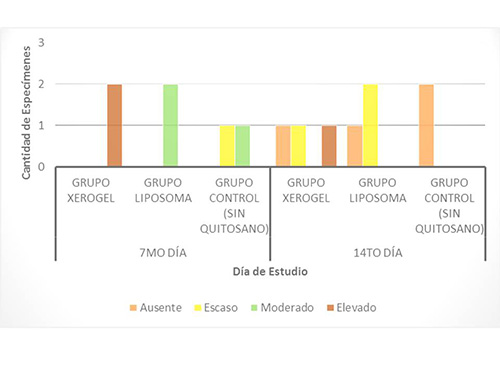 La observación de éstos resultados en los grupos experimentales, podrían deberse a una activación de un grupo de enzimas plasmáticas que potencian la respuesta inflamatoria, debido a la estimulación persistente, realizada por la presencia del quitosano de manera intra-alveolar, que desencadena una respuesta inflamatoria crónica, induciendo la migración de células, ya que por ser un biomaterial de origen heterólogo y no tóxico, el organismo tratará de degradarlo. Esta respuesta es totalmente normal, comprendiendo que la función de la inflamación es destruir, diluir o limitar cualquier agente extraño y a su vez reparar, curar y reconstruir el tejido perdido, mediante la aceleración de la proliferación de los fibroblastos provenientes del tejido conectivo y de los vasos sanguíneos, que se adhieren al biomaterial y se organizan en la formación del tejido de granulación. Estos resultados presentan semejanzas a los estudios realizados por Fwu-long y cols. (2001)(33), Park y cols. (2003)(26), Senel y cols. (2004)(35), Yufeng y cols. (2006)(25), Espinoza (2007)(40), Jorguera y cols. (2008)21(20) y Akman y cols. (2010)(24), quienes investigaron las propiedades regenerativas y el efecto del quitosano como un apósito de heridas y para la Regeneración Tisular Guiada (RTG). Formación de Tejido de granulación. La presencia de tejido de granulación, en la primera evaluación de éste parámetro estuvo más acentuada en el grupo liposoma, ya que se presentó 1 rata con formación elevada del mismo y 1 rata con formación escasa. En el grupo xerogel y el grupo control, los resultados fueron similares, ya que tenían 2 animales en un nivel de formación moderado cada uno. En la segunda evaluación, que corresponde al 14to día, la formación de este tejido disminuyó, manifestando un nivel escaso de formación de tejido de granulación en la totalidad de los grupos (8 ratas). Figura8. Formación de Tejido de granulación a los 7 y 14 días, en los animales del estudio. 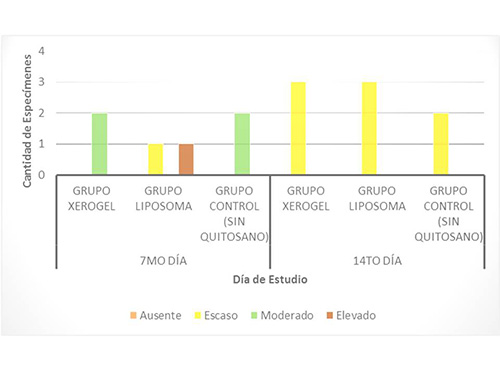 El hecho de que se haya formado tejido de granulación elevado en uno de los especímenes a los 7 días, supone el inicio de la maduración del tejido alveolar más rápido en el grupo liposoma, seguido del grupo xerogel. Demostrándose con esto, que el quitosano posee actividad osteoinductora como lo confirman los estudios realizados por Yufeng y cols. (2006)(25), Espinoza (2007)(40) y Akman y cols. (2010)(24) quienes describen el quitosano, como promotor de la formación de hueso. Formación de Zonas osteoides. Al realizar la primera evaluación (7mo día), la cantidad de zonas osteoides fue escasa en las muestras de las ratas del grupo xerogel y liposoma.
En el grupo control, una de las ratas desarrollo escasas zonas osteoides y en la otra, no se formó este indicador. En la evaluación del 14to día, se desarrolló un aumento de zonas osteoides en la mayoría de las muestras analizadas de los animales del experimento. Este aumento fue duplicado en el grupo xerogel, con todas las ratas en grado de formación elevado, comparado con el grupo liposoma que tuvo 2 ratas en nivel elevado y 1 en nivel moderado. En el grupo control hubo 1 rata con formación moderada y 1 con formación escasa. (Figura9) Estos resultados sugieren que la presencia del quitosano en el alvéolo, acelera la diferenciación de células osteogénicas (osteoblastos y osteoclastos), para que se inicie la deposición de osteoide a lo largo del hueso alveolar, en la última etapa del proceso de regeneración o maduración de la herida.Al analizar los preparados histológicos, se encontró que los resultados de la formación de zonas osteoides, fue mayor en proporción y en densidad ósea, en las ratas pertenecientes al grupo xerogel, seguida del grupo liposoma y en último lugar el grupo control. Figura9. Formación de Zonas Osteoides a los 7 y 14 días, en los animales del estudio. 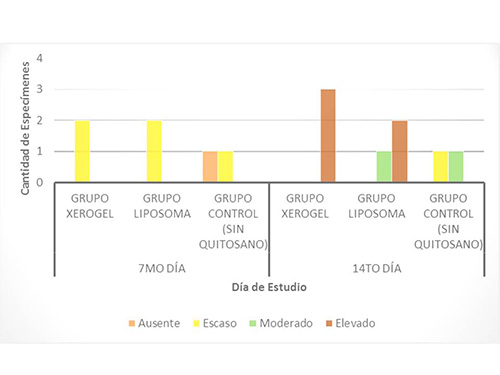 Esto demuestra, que la presencia del biomaterial en defectos óseos, favorece la regeneración ósea, como se observa en los estudios de Park y cols. (2003)(26), Larena y cols. (2005)(41), Shin y cols. (2005)(42), Yufeng y cols. (2006)(25), Suphasiriroj y cols. (2008)(43), Park y cols. (2008)(44), Moreau y cols. (2009)(45), Noroswki y cols. (2009)(46) y Akman y cols. (2010)(24), quienes afirman el uso de este biomaterial para técnicas de regeneración ósea guiada, ya que mejora el cultivo, transporte, fijación y desarrollo de osteoblastos, debido a su mejor fijación en superficie y progreso. Focos de mineralización de zonas osteoide y Presencia de hueso maduro. La evaluación de éstos indicadores es de carácter secundario en este estudio, ya que principalmente se valoró la remisión de la osteítis alveolar, y secundariamente la regeneración ósea como un indicador de sanidad de los tejidos. Es por ello que el experimento fue planificado para ser realizado y evaluado en quince (15) días, promedio normal en el que la osteítis alveolar es remitida en los seres humanos, pasado este tiempo si no mejoran la sintomatología del paciente, se comienza a pensar en una osteomielitis. Los focos de mineralización de las zonas osteoides y la presencia de hueso maduro, no se observó en ninguno de los animales, en las evaluaciones realizadas, ya que se necesitan más de dos (2) semanas para apreciar éstos últimos indicadores de regeneración. Es por ello que no se realizaron gráficos sobre estos parámetros; sin embargo siguen formando parte del estudio, ya que se encuentran dentro de los niveles de regeneración ósea en la escala propuesta por Castillo L. en el 2009.(28) Regeneración Ósea según Castillo L. (2009). Por último, se utilizó la escala cualitativa propuesta por Castillo L. en el año 2009(28), para determinar el Nivel de maduración de la Regeneración Ósea Guiada (ROG). Los resultados obtenidos en la primera evaluación (7 días), revelan que la totalidad de las muestras analizadas, se ubicaron en un NIVEL I de regeneración. Yfinalmente, en la segunda evaluación correspondiente a los 14 días de este estudio, se observó un aumento de los niveles de regeneración de los grupos tratados con quitosano (xerogel y liposoma), ya que se ubicaron en el NIVEL II de regeneración. No obstante, una de las ratas pertenecientes al grupo control, permaneció en un NIVEL I, y el otro animal aumento de nivel ubicándose de en el NIVEL II. (Figura 10) Según ésta escala, los grupos tratados con xerogel y liposoma de quitosano presentaron un mayor nivel de regeneración ósea, afirmando que éste biomaterial funcionó muy bien como una guía útil en la regeneración ósea. Es importante resaltar, que la osteítis alveolar se caracteriza por una perturbación de la cicatrización y regeneración del alvéolo, debido al desalojo parcial o total, o la mala organización del coágulo sanguíneo en el hueso alveolar. Al observar en los resultados del presente estudio, una aceleración de éste proceso regenerativo, se podría inferir que la ésta patología presente en las ratas Wistar, remite en menor tiempo y de forma más organizada, al utilizar este biomaterial como tratamiento alternativo natural y de acción local. Figura 10. Niveles de Regeneración Ósea según la escala de Castillo L. (2009) a los 7 y 14 días, en los animales del estudio. 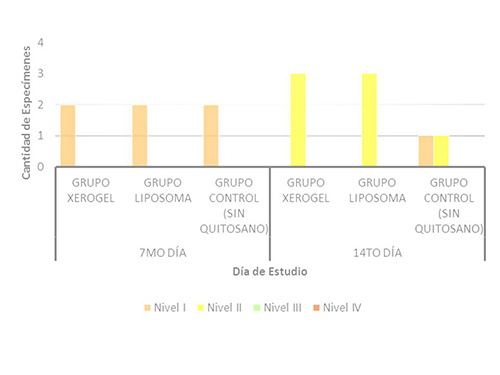 En resumen, tanto el liposoma como el xerogel presentaron excelente respuesta para la remisión de la patología. Sin embargo, el xerogel tuvo mejores resultados histológicos, semejantes al liposoma, ya que ambos materiales presentaron zonas de formación osteoides aumentadas, pero en el caso del xerogel, estas se observaron más densas. En consecuencia, el mejor tratamiento para la osteítis alveolar es el xerogel a base de quitosano, ya que produce una regeneración ósea acelerada en comparación con el grupo control. Conclusiones
En los hallazgos histológicos, se encontró que en el grupo de animales a los que se les implantó el liposoma a base de quitosano, tuvieron un mayor porcentaje de formación de tejido conjuntivo, vasos sanguíneos y tejido de granulación, es decir su efecto es más acentuado en la regeneración de los tejidos blandos. De los hallazgos histológicos analizados, se puede concluir que hubo mayor cantidad de macrófagos, linfocitos, plasmocitos y zonas osteoides en las ratas tratadas con xerogel. Dichas zonas osteoides se duplicaron a los 14 días, lo que indica que el xerogel comenzaba a actuar como andamio para la regeneración ósea en los alvéolos dentales. Ambas presentaciones a base de quitosano, resultaron ser efectivas como una opción terapéutica válida para el tratamiento de la osteítis alveolar en ratas Wistar. Efecto terapéutico que podría ser obtenido también en osteítis alveolar en humanos. Recomendaciones
Para estudios posteriores, se sugiere el incremento del número de ejemplares biológicos por grupo experimental y control, además de tiempo de estudio.
Evaluar la eficiencia del liposoma y del xerogel a base de quitosano para la osteítis alveolar en humanos.
Evaluar la propiedad de Regeneración Ósea Guiada del quitosano en alvéolos dentales de animales de laboratorio, con un tiempo más prolongado que el de este estudio.
Realizar estudios comparativos entre tratamientos convencionales para la osteítis alveolar, como por ejemplo Alvogyl® y quitosano en humanos. REFERENCIAS
1. Peñaloza U. Complicaciones post-exodoncia más frecuentes en pacientes de la clínica odontológica de la Universidad Nacional Jorge Basadre Grohmann. Revista Médica Basadrina. 2009;3(1):12-15
2. Martín O, Lima M, Zuleta M. Alveolitis. Revisión de la Literatura y Actualización. Rev Cub Estomatol 2001;38(3):176-803.
3. Martín O, Paz E, Romero C, Mejías M. Láser Terapéutico en el tratamiento de las Alveolitis. Instituto Superior de Ciencias Médicas. 2009. [Citado 15 de julio de 2010]. Disponible en http://www.monografias.com/trabajos28/laser-Osteítis Alveolar/laser-Osteítis Alveolar.shtml
4. Díaz A, Montero A, González M. Tratamiento de la Alveolitis con extracto Acuoso de Aloe Vera [internet]. Argentina: Hospital Oncológico María Curie [Citado 15 de Julio de 2010]. Disponible en: http://www.revistaciencias.com/publicaciones/EEZFllZpkyDGMXPxfy.php
5. Torres D, Serrera M, Romero M, Infante P, García M, Gutiérrez J. Alveolitis Seca. Actualización de Conceptos. Med Oral Patol Oral Cir Bucal. 2005;10(1):77-85
6. Contreras M, Lleras M. Uso de la clorhexidina al 0,12% como método preventivo de la osteítis alveolar en pacientes con extracción indicada del tercer molar inferior incluido [tesis]. Mérida, Venezuela: Universidad de Los Andes, Facultad de Odontología; 2005
7. Marimón M, Corbo M, Cabeza H, Ferro A. Cirugía Ambulatoria con Anestesia Local en el Tratamiento de la Comunicación Buco Sinusal mediata y tardía. Rev Ciencias Médicas. 2008;12(2):70-79
8. Tan N, Hidalgo C, Tan S, Rodríguez G, Fernández N. Tratamiento homeopático vs Alvogyl. Rev AMC. 2008;12(3):0-0. Disponible en: http://scielo.sld.cu/pdf/amc/v12n3/amc08308.pdf
9. Nápoles I, Batista X, Rivero O, Díaz S, Fernández N. Incidencia de la Alveolitis. Rev AMC. 2009;13(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-02552009000200004&lng=en
10. Osorio M. Confección, Validación y aplicación de uma prueba de conocimientos sobre Alveolitis [Tesis]. Ciudad de la Habana: Facultad Estomatología Raúl González Sánchez; 2007
11. Arteagoitia M, DiezM, Barbier L, landa S, Santamaria G, Santamaria J. Antibioterapia sistémica preventiva de la Alveolitis seca en la exodoncia del tercer molar inferior: revisión sistémica. RCOE. 2002;7(6):603-611
12. Martínez R, Mingo P, Giner J, Marqués F. Sultamicilina: estudio de la complicación infecciosa en la exodoncia de terceros molares. RCOE. 2002;7(6):591-597
13. Borges R, Sampayo Y, Menéndez J, Sánchez J, Castro D, Menéndez E. Evaluación de pacientes afectados de Alveolitis: Uso del metronidazol tópico en dosis única. Gaceta Médica Espirituana. 2009 [citado el 15 Julio de 2010];11(1). Disponible en: http://www.bvs.sld.cu/revistas/gme/pub/vol.11.(1)_03/p3.html
14. Torres M, Díaz M, Acosta A. La Clorhexidina, bases estructurales y aplicaciones en la estomatología. Gaceta Médica Espirituana. 2009 [citado el 15 de Julio de 2010];11(1). Disponible en: http://www.bvs.sld.cu/revistas/gme/pub/vol.11.(1)_08/p8.html
15. Martin O, Ferrales Y, Fernández C. Eficacia de la magnetoterapia en el tratamiento de la Alveolitis. Rev AMC. 2010;1(14). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-02552010000100010&lng=es
16. Cruz O, Menéndez S, Martínez M, Clavera T. Aplicación de la ozonoterapia en el tratamiento de la Alveolitis. Rev Cubana de Estomatol. 1997;34(1):21-24
17. Peña A, Martín O. Evaluación del postoperatorio en exodoncias con electroacupuntura vs tratamiento convencional. AMC. 2003 [Citado el 18 Julio 2010];7(5). Disponible en: http://www.amc.sld.cu/amc/2003/v7supl1/700.htm
18. Hernández D, Trujillo B, Brito L, Cuadrado L. Utilización de la terapia floral en la Alveolitis mediante el empleo de los patrones transpersonales. [internet] 2002 [citado el 15 de agosto de 2010]. España. Disponible en: http://www.sedibac.org/temas/tema.alveolitis.pdf
19. Gómez Y, Vilvey L, Sánchez L, Díaz L. Uso de propóleos al 5% en el tratamiento de la Alveolitis. Gaceta Medica Espirituana. 2008;10(1). Disponible en http://www.bvs.sld.cu/revistas/gme/pub/vol.10.(1)_06/p6.html
20. Jorquera R, Jorquera O, Rivera S. Quitosano: Un material con Propiedades regenerativas y su Aplicación Clínica [internet]. REDOE. 2008 [Citado el 10 de julio de 2010]. Disponible en: http://www.redoe.com/ver.php?id=100
21. Lárez C. Quitina y Quitosano: Materiales del pasado para el presente y el futuro. Rev Avances en Química. 2006;1(2):15-21
22. Marguerite R. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 2006;31(7):603-632
23. Veiga M, Ruiz R. El Quitosano: Usos farmacéuticos y biológicos. Rev OFIL. 2004;14(2):33-42
24. Akman A, Tığlı R, Gümüşderelioğlu M, Nohutcu R. bFGF-loaded HA-chitosan: A promising scaffold for periodontal tissue engineering. J Biomed Mater Res Part A. 2010;92A(3):953-962
25. Yufeng Z, Yining W, Bin S, Xiangrong C. A platelet-derived growth factor releasing chitosan/coral composite scaffold for periodontal tissue engineering [Resumen]. 2006 [Citado el 20 de Julio de 2010]
26. Park J, Choi S, Moon I, Cho K, Chai J, Kim C. Eight-week histological analysis on the effect of chitosan on surgically created one-wall intrabony defects in beagle dogs [resumen]. J Clin Periodontol. 2003;30(5):443-453
27. Arias F. El proyecto de Investigación. Introducción a la metodología científica. 5ta ed. Caracas, Venezuela: Episteme; 2006
28. Castillo L. Efectos del Plasma Rico en Plaquetas sobre la regeneración ósea: estudio en animales de laboratorio [tesis]. Mérida, Venezuela: Universidad de Los Andes, Facultad de Odontología; 2009
29. Dias J, Oliveira S, Bosco A, Schweitzer C, Jardim E. Influence of Local Tetracycline on the Microbiota of Alveolar Osteitis in Rats. Braz Dent J. 2008;19(2):119-123
30. Rodrigues M, Cardoso C, Carvalho P, Cestary T, Feres M, Garlet G, Ferreira O. Experimental alveolitis in rats: microbilogical, acute face response and histometric characterization of delayed alveolar healing. J APPL Oral SCI. 2011. 19 (3): 260-268.
31. Silva M, Dias E, Milanezi L, Okamoto T, GabrielliM, Chiarelli M. Estudio Histológico del proceso de reparación alveolar después de la aplicación tópica de la solución anestésica prilocaína 3% con felipresina 0,03 UI/ML. Acta Odontológica Venezolana. 2010. 48 (3):1-12.
32. Knapczyk J. Preclinical study of antimycotic chitosan hydrogel efficacy. Chitin World. 1994;5(3):512-519
33. Fwu-Long M, Shin-Shing S, Yu-Bey W, Sung-Tao L, Jen-Yeu S, Rong-Nan H. Fabrication and characterization of a sponge-like asymmetric chitosan membrane as a wound dressing [resumen]. Biomaterials. 2001;22(2):165-173
34. Lárez Cl. Algunos Usos del Quitosano en Sistemas Acuosos. Rev Iberoamericana de Polímeros. 2003;4(2):91-109
35. Senel S, McClure S. Potential applications of chitosan in veterinary medicine. Advance drug Deliv Rev. 2004;10(56):1467-1480
36. Shen E, Chou T, Gau C, Tu H, Chen Y, Fu E. Releasing growth factors from activated human platelets after chitosan stimulation: a posible bio-material for platelet-rich plasma preparation [resumen]. Clin Oral Impl Res. 2006;17(5):572-578
37. Malette W, Quigley H, Gaines R, Johnson N, Rainer W. Chitosan: A new hemostatic. Ann Thorac Surg. 1983;36(1):55-58
38. Rao S, Sharma C. Use of chitosan as a biomaterial: Studies on its safety and haemostatic potential [resumen]. J Biomed Mater Res. 1997;34(1):21-28
39. Hoekstra A, Struszczyk H, Kivekâs O. Percutaneous microcrystalline chitosan application for sealing arterial puncture sites [resumen]. Biomaterials. 1998;19(16):1467-1471
40. Espinoza E. Propiedades Físicas y Biológicas de dos tipos de esponjas de Quitosano para su aplicación como biomaterial [tesis]. Lima, Perú: Universidad Nacional Mayor de San Marcos, Facultad de Odontología; 2007
41. Larena A, Cáceres A, De la Piedra C, Montero M, Vicario C, Fuentes A, Ibarzábal A, Bernabeu E, Ribelles P. Preparación de biomateriales basados en quitosano y estudios como portadores de osteoblastos en cultivo. Patología del Aparato Locomotor de la Fundación Mapfre Medicina. 2005;3(1):55-63
42. Shin S, Park H, Kim K, Lee M, Choi Y, Park Y, Lee Y, Ku Y, Rhyu I, Han S, Lee S, Chung C. Biological evaluation of chitosan nanofiber membrane for guided bone regeneration [resumen]. J Periodontol. 2005;76(10):1778-1784
43. Suphasiriroj W, Yotnuengnit P, Surarit R, Pichyangkura R. The fundamental parameters of chitosan in polymer scaffolds affecting osteoblasts (MC3T3-E1) [resumen]. J Mater Sci: Mater Med. 2008;1(20):209-320
44. Park S, Kim S, Lim S, Ong J. Osteogenic activity of the mixture of chitosan and particulate dentin. J Biomed Mater Res A. 2008;87(3):618-23
45. Moreau J, Xu H. Mesenchymal stem cell proliferation and differentiation on an injectable calcium phosphate-chitosan composite scaffold. Biomaterials. 2009;30(14):2675-2682
46. Noroswki P, Bumgardner J. Review Biomaterial and Antibiotic strategies for Peri-implantitis. J Biomed Mater Res B. 2009;88B(2):530-543
|
 Información General
Información General Artículos
Artículos Notícias
Notícias Enlaces
Enlaces Contactar
Contactar Buscar
Buscar Premio Nadal
Premio Nadal Formación Continuada
Formación Continuada
