| |
Esquembri-Bescós, Noelia (1); Berini-Aytés, Leonardo (2); Gay-Escoda, Cosme (3). (1) Odontóloga. Residente del Máster de Cirugía Bucal e Implantología Bucofacial. Facultad de Odontología de la Universidad de Barcelona. Odontólogo. (2) Doctor en Medicina. Estomatólogo. Especialista en Cirugía Maxilofacial. Profesor titular de Patología Quirúrgica Bucal y Maxilofacial. Profesor del Máster de Cirugía Bucal e Implantología Bucofacial de la Universidad de Barcelona. Investigador del Instituto IDIBELL. (3) Doctor en Medicina. Estomatólogo. Especialista en Cirugía Maxilofacial. Catedrático de Patología Quirúrgica Bucal y Maxilofacial. Director del Máster de Cirugía Bucal e Implantología Bucofacial. Facultad de Odontología de la Universidad de Barcelona. Investigador-coordinador del Instituto IDIBELL. Jefe del Servicio de Cirugía Bucal, Implantología Bucofacial y Cirugía Maxilofacial del Centro Médico Teknon. Barcelona. Correspondencia: Dr. Cosme Gay Escoda
Centro Médico Teknon
Vilana 12
08022 Barcelona
Teléfono: 93 402 42 74
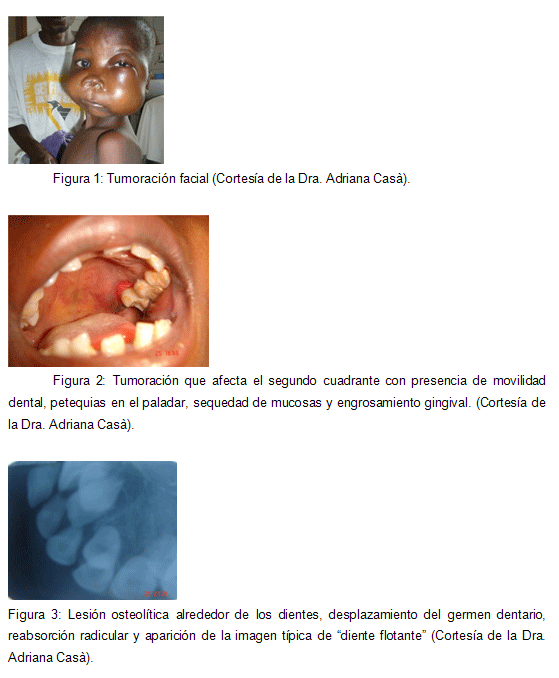
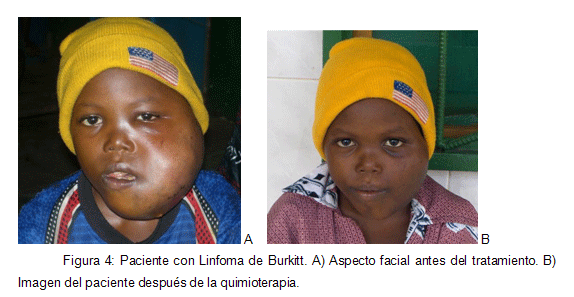
Fax: 93 393 30 70 RESUMEN Introducción: Los linfomas de la cavidad bucal corresponden a menos del 5% de los cánceres bucales. El linfoma de Burkitt (LB) es una forma de linfoma no Hodgkin (LNH) de rápido crecimiento, de alto grado de malignidad, que aparece preferentemente en niños. Existen 3 tipos: el endémico (africano), el esporádico (americano) y el tipo asociado a estadios de inmunodeficiencia. Predomina en el género masculino siendo más frecuente en la mandíbula. La etiología es desconocida, pero se ha demostrado que el virus de Epstein-Barr (VEB), el virus de la inmunodeficiencia humana (VIH) y el parásito Plasmodium falciparum están implicados en su etiopatogenia. La clínica del LB es muy variada. Objetivos: Conocer la incidencia del LB, su distribución geográfica, clínica, evolución y tratamiento; para poder efectuar un correcto diagnóstico precoz. Metodología: Búsqueda bibliográfica en Pubmed. Palabras clave: Burkitt's lymphoma, non Hodgkin lymphoma, pathogenesis, early diagnosis, radiology, prognosis, treatment and oral cavity. Se obtuvieron 194 artículos. Se aplicaron los siguientes límites: idioma (español, inglés y francés), estudios efectuados en humanos y publicados en los últimos 15 años, obteniendo 167 artículos. De éstos se seleccionaron 59 artículos que eran correctos metodológicamente. Resultados y Discusión: El diagnóstico de presunción precoz se basa fundamentalmente en una buena historia clínica. La exploración clínica general permite identificar adenopatías, alteraciones abdominales y/o afectación del estado general, ayudándonos de exploraciones complementarias como la radiografía de tórax, la tomografía computadorizada o la tomografía por emisión de positrones. A nivel bucodental empleamos la ortopantomografía o las radiografías periapicales para la identificación de lesiones osteolíticas alrededor de los dientes, fractura o pérdida de las criptas y de la lámina dura, desplazamientos de gérmenes dentarios, reabsorciones radiculares, borramiento del reborde del seno maxilar y/o imágenes en "rayos de sol". El diagnóstico de certeza nos lo proporciona la biopsia que permite el estudio anatomopatológico e inmunohistoquímico. Conclusiones: Es importante aprender a identificar cualquier patología con repercusión bucal ya que de nosotros depende hacer un diagnóstico precoz correcto, y por tanto aumentar la tasa de supervivencia de los pacientes con éste tipo de patología. Palabras clave: Linfoma de Burkitt, linfoma no Hodgkin. Título corto: Linfoma de Burkitt. Burkitt's lymphoma: Incidence, diagnosis, evolution and treatment. ABSTRACT Background: oral cavity lymphomas represent less than 5% of buccal cancers. Burkitt's lymphoma (BL) is a fast-growing no-Hodgkin lymphoma, with a high malignity-grade that appears mostly in children. 3 types of BL are described: endemic (african), sporadic (american), and inmunodeficiency-related type. It ussually appears in males, and is more often seen in the mandible. Its aethiology is not clear, although it has been demonstrated that Epstein-Barr Virus (EBV), Human Inmunodeficiency Virus (HIV) and the Plasmodium Falciparum parasite are involved on it. The clinical appearance is ofted miscellaneous, with different signs and sympthoms. Objectives: to describe the incidence of BL, its geografic distribution, clinical appearance, development and treatment, so a correct early diagnosis can be made. Methodology: Systematic bibliografic search in PubMed. Key words: Burkitt's lymphoma, early diagnosis and epidemiology. 194 articles were obtained. Applied limits: language (Spanish, English and French), studies made in humans and published in the last 15 years; obtaining 167 papers. Finally, 59 metodologically-correct articles were selected. Results and Discussion: Early presumption diagnosis is maily based on a correct medical history. General clinical examination identifies adenopathies, abdominal disorders and/or systemic involvement; additional examination such as torax radiography, computerized tomography or positron emission tomography may be helpful. In our field, panoramic and/or periapical radiographies can be used for teh identification of radiolucent images surrounding teeth, bone criptae/lamina dura loss or fracture, dental germs displacement, root resorption, loss of the maxillary sinus borderline and/or "ray of light" radiographic bone images. Final diagnosis is given by the anatomopathological and inmunohistochemical analyses achieved by the biopsy of the lesion. Conclussions: It is very important to identify any pathologic condition that may have buccal implications, for it relays on us the task of making a correct early diagnosis, increasing the survival rate of patients suffering from BL. Key Words: Burkitt's lymphoma, No-Hodgkin lymphoma. Short title: Burkitt's lymphoma. 1. INTRODUCCIÓN El término linfoma se refiere a un grupo de tumores sólidos que afecta las células del sistema linforreticular o inmunitario, como los linfocitos B y T y los monocitos. Los linfomas de la cavidad bucal representan menos del 5% de los cánceres bucales. El carcinoma de células escamosas y las neoplasias de las glándulas salivales son los cánceres bucales más frecuentes, ocupando el primer y segundo lugar respectivamente, seguidos en tercer lugar por los linfomas (1,2). El linfoma de Burkitt (LB), también conocido como linfoma de células B, linfoma de alto grado de células B o linfoma de células pequeñas no divididas, según la Organización Mundial de la Salud (OMS) es una forma de linfoma no Hodgkin (LNH) de rápido crecimiento, de alto grado de malignidad, indiferenciado y difuso, que aparece en niños, presentando características multifocales y afectando vísceras abdominales, pelvianas o ambas, tejidos blandos retroperitoneales, el maxilar superior y la mandíbula y los ganglios linfáticos. Es una linfoproliferación neoplásica B monoclonal con susceptibilidad para originarse en cualquier territorio con presencia de tejido linfoide (3, 4, 5). Fue descrito en Uganda en el año 1958 por el cirujano inglés Denis Burkitt, quién observó entre la población infantil del este de África la existencia de tumoraciones que afectaban a los huesos faciales (tumores linfoides mandibulares) y al abdomen. Burkitt lo consideró un sarcoma mandibular que aparecía principalmente en niños de 14 años de edad. A partir de la década de los 60 se registran casos en los Estados Unidos de Norteamérica (EE.UU.) y Europa que presentan un patrón clínico epidemiológico diferente en relación a la forma africana y que se conoce actualmente como variante americana (6, 7). Actualmente se acepta que existen 3 tipos de LB: el endémico (forma africana), el esporádico (forma americana) y el tipo asociado a estadios de inmunodeficiencia (8, 9). Tanto la clasificación de Murphy como la de Ziegler, ambas de 1977, son válidas para estudiar el tumor y pronosticar la respuesta al tratamiento (4, 10) (Tabla 1). La mayoría de autores describen que el LB predomina en el género masculino en proporciones que oscilan entre 4:1 y 8:1. La incidencia dependiendo de la zona estudiada varía ampliamente, siendo de 2,4 casos/100.000 habitantes/año en Uganda o de 9,1 casos/1.000.000 habitantes/año en México. La edad media de aparición es de 4 a 6 años (2,11). La presentación del LB en edad adulta resulta atípica, viéndose favorecida por la concomitancia de estados de inmunodepresión, como el síndrome de Wiskott-Aldrich, la ataxia-telangiectásica, el síndrome de Chediak-Higashi, o el síndrome de la inmunodeficiencia humana (S.I.D.A). Este último es el estado de inmunodepresión que con mayor frecuencia se asocia al LB. Más del 95% de los casos de LNH en pacientes VIH-positivos (virus de la inmunodeficiencia humana) son de fenotipo B y tienen un grado de malignidad intermedio o alto (12). Un estudio del Instituto de Cancerología de los EE.UU. mostró que el LB es más frecuente en la mandíbula, y de presentación unilateral. En México los datos del Instituto Nacional de Pediatría (INP) muestran que en el maxilar superior solo aparece en el 13'3% de los casos (2). La etiología del LB es desconocida. En 1996 Epstein cultivó las células del tumor y puso en evidencia la presencia de un virus ADN, demostrando por el estudio de sus propiedades inmunológicas, que el virus de Epstein-Barr (VEB) tenía un papel etiopatogénico. El LB endémico está estrechamente asociado con el VEB, principal causante de la mononucleosis infecciosa, siendo su seroprevalencia del 98%. Por contra, la forma americana no está ligada al virus ya que solo en el 25% de los casos se relacionan con este. Además en la variante no endémica la detección de títulos elevados de anti-cápside viral parece relacionarse con un peor pronóstico de la enfermedad (13-16). Como cofactores se incluyen determinadas alteraciones cromosómicas, la malaria, defectos inmunitarios y déficits proteicos (17-19). En pacientes VIH-positivos, el papel del agente transformador que ejerce el VEB en la forma endémica lo asume el VIH. Éste promueve la expresión de citocinas inmunoblásticas cuyas funciones redundan en la activación de los oncógenes c-myc por translocaciones, o del bcl-6 y bcl-2 por disregulaciones, sin olvidar la inactivación del antioncogen p53. Así, el VIH no influye sólo en la expansión policlonal de los linfocitos B a través de las interleucinas 6, 10 y 12, si no que aminora la respuesta al tratamiento y obliga cada vez con mayor frecuencia a efectuar abordajes quirúrgicos, hasta ahora, desaconsejados en este tipo de patología (18, 19). 2. CLÍNICA Los autores describen 3 variantes de LB: la forma endémica (africana), la esporádica (americana) y la asociada a estadios de inmunodeficiencia. La forma africana o endémica se caracteriza por una tumoración de rápido crecimiento presente en los maxilares casi en el 60% de los casos. La nasofaringe, la orofaringe, las gónadas o el estómago son otras localizaciones descritas en la literatura. En la infancia las zonas más afectadas son la mandíbula con un 51'6% de los casos y el abdomen con un 25% de los casos. En el 13'8% se presenta en ambas localizaciones y en el 9'6% en otras áreas. En los adultos aparece en un 43'2% de los casos en el abdomen y en un 4'5% en la mandíbula. La afectación del sistema nervioso central, de la glándula tiroides o de las glándulas salivares es más frecuente en la forma americana que en la africana (4, 9, 20, 21). La separación geográfica del tipo endémico y de la variedad esporádica no es absoluta, puesto que el tipo esporádico puede acontecer en áreas endémicas y viceversa. Los subtipos son histológicamente indistinguibles pero pueden tener diferente epidemiología y diferentes características biológicas. Históricamente la distribución geográfica del LB en África ecuatorial coincide con áreas llanas, cálidas y húmedas con una alta tasa de malaria (11, 15, 21-23). En África el LB endémico presenta una incidencia de 50-100 casos/millón/año y representa más del 70% de los tumores malignos en niños, siendo entre los 5 y 7 años el pico de máxima incidencia (4, 9, 20, 21). Sin embargo la variante americana no presenta carácter endémico, presentando una incidencia de un caso/millón/año. El pico de máxima incidencia se sitúa entre los 10 y 12 años (4, 20, 21). La obstrucción de las vías respiratorias, intestinales y/o urinarias suele ser más común que en la forma africana (12, 21, 22). En pacientes inmunodeprimidos se registra una mayor frecuencia de LNH. Más del 95% son de estirpe B y tienen un grado de malignidad alto o intermedio. De los linfomas asociados al S.I.D.A, el LB es el más común, representando el 36% de los casos. Este presenta una rápida progresión clínica, una mayor afectación extranodal y una edad de aparición muy variable. La prevalencia de los linfomas linfocítico y histiocítico en estos pacientes suponen el 34'5 y 8'2% de los casos respectivamente (12, 23). La clínica del LB es muy versátil. 2.1. Manifestaciones sistémicas: El LB endémico inicialmente suele presentarse como una inflamación de los ganglios linfáticos del cuello y/o de los ganglios inguinales. Estos con frecuencia son indoloros y de crecimiento rápido. En la forma americana, la enfermedad generalmente comienza en el área abdominal, como un dolor en el cuadrante inferior derecho o con obstrucción intestinal aunque también puede iniciarse en otras partes del cuerpo como los ovarios, los testículos o el cerebro (5, 21, 24). La adenopatía cervical medial ocurre en más del 70% de los casos. Entre las cadenas ganglionares más afectadas se encuentran las cervicales, las supraclaviculares, las mediastínicas, las intraabdominales, las inguinales y las axilares (25). A nivel abdominal los signos más habituales son las masas mediastínicas junto a la hepatomegalia y la ascitis (7, 20). A nivel del sistema nervioso central podemos encontrarnos con cefalea, paraplejía y alteraciones de los pares craneales (21, 26, 27). Otra sintomatología más polimorfa que puede acontecer son la fiebre (concomitante con diaforesis), mareos y/o vómitos, malaabsorción gastrointestinal con la consecuente pérdida de peso, dolor abdominal intenso, astenia, artritis, anemia, cuadros agudos de apendicitis, alteraciones respiratorias y/o tumores ováricos o testiculares (7, 9, 20, 25, 28). En la literatura se describen casos en los que podemos apreciar una clínica atípica entre la que destaca la anestesia del labio inferior, los abscesos dentarios, la afectación del seno cavernoso o del cordón espermático, el derrame pleural o la afectación del suelo de la boca. Esta clínica tan dispar dificulta la obtención de un diagnóstico precoz y correcto (26, 28-31). 2.2. Manifestaciones bucales: La tumoración facial, el dolor y la pérdida prematura de los dientes son los signos más precoces y frecuentes entre las manifestaciones bucofaciales. Las lesiones comienzan en el interior del hueso (procesos alveolares), invaden los espacios medulares, crecen rápidamente con una media de 4 semanas y llegan a producir deformación facial generalmente sin ulceración de la piel. Según la localización de estos tumores podemos observar que la tumoración afecta a uno o varios cuadrantes de la boca (30-32) (Figura 1). Si exploramos los tejidos blandos observaremos petequias en el paladar y una encía engrosada, roja, seca, brillante y dolorosa a la palpación (21, 27, 30-32) (Figura 2). El desplazamiento y la movilidad de los dientes son los signos más comunes entre los tejidos duros, siendo los premolares y los molares los dientes más afectados. La versión vestíbulo-lingual y la extrusión son los desplazamientos dentarios más habituales (9, 30-32). Si se realiza una exodoncia a un paciente con LB deberemos explorar detenidamente la zona ya que podremos observar un proceso de cicatrización anormal. El alvéolo puede ser ocupado por una zona de tejido de granulación, irregular, de consistencia blanda, ulcerada, de olor fétido, de coloración grisácea junto a zonas de necrosis (30). Hay que tener presente que las lesiones periapicales tienen una presentación clínica y radiológica similares, por lo que debemos hacer un correcto diagnóstico diferencial (27, 33). Otros síntomas y signos que podemos encontrar son la imposibilidad para deglutir y/o hablar en casos avanzados donde la extensión del tumor puede superar los varios centímetros de diámetro, dolor a la apertura y cierre de la boca y la anestesia o parestesia del nervio dentario inferior si la tumoración comprime esta estructura. Los tumores mandibulares han sido confundidos frecuentemente con abscesos de origen dentario, osteomielitis, fibromas osificantes, rabdomiosarcoma embrional, osteosarcoma, quiste dentígero, linfoma no Hodgkin, retinoblastoma, carcinoma de células escamosas, granuloma eosinófilo, ameloblastoma, neuroblastoma y displasia fibrosa, por lo que debemos incluirlos todos en el diagnóstico diferencial (34, 35). El diagnóstico diferencial de los dientes con movilidad en ausencia de factores locales incluye la periodontitis juvenil generalizada, la periodontitis asociada al S.I.D.A, la histiocitosis de células de Langerhans, el síndrome de Papillon-Lefèvre, la hipofosfatasia, la neutropenia cíclica, el raquitismo resistente a la administración de vitamina D, la acrodinia y los linfomas (21, 30, 32). El LB puede afectar el seno maxilar y/o las fosas nasales. Los linfomas nasosinusales suelen debutar con síntomas inespecíficos como obstrucción nasal, rinorrea o epistaxis. Posteriormente, como consecuencia de la afectación de los órganos vecinos, pueden aparecer cuadros de disminución de la agudeza visual, tumefacción hemifacial, parestesias faciales, etc. En fases avanzadas aparecen síntomas sistémicos como la fiebre, fatiga, dolores óseos o abdominales. Existen pequeñas variaciones clínicas en función del tipo de linfoma. Así tenemos, por ejemplo, que en los LNH de alto grado de malignidad tipo T es más frecuente que exista perforación septal y destrucción nasal, mientras que los de alto grado tipo B, entre los que se incluye el LB, tienen más tendencia a invadir los tejidos vecinos y la órbita (4). 3. ESTUDIOS RADIOLÓGICOS 3.1. Radiología convencional La radiología convencional, como la ortopantomografía o la radiografía periapical (en el campo de la Odontología), puede revelarnos la existencia de una lesión compatible con LB y de hecho muchas veces es el primer hallazgo que permite llegar a un diagnóstico correcto. Las características radiológicas de las lesiones en los maxilares compatibles con el tumor revisado no suelen ser muy específicas. Los cambios osteolíticos son los más habituales y siempre requieren un diagnóstico diferencial muy meticuloso entre diferentes entidades como la periodontitis juvenil localizada, las infecciones odontogénicas, la osteomielitis, el hipoparatiroidismo, la hipofosfatasia, la histiocitosis-X o los granulomas eosinófilos, los tumores de los maxilares (ameloblastoma y osteosarcoma), las metástasis secundarias a otras neoplasias, entre un amplio abanico de patologías (9, 21, 36). Los cambios que se pueden observar en este tipo de radiografías son lesiones osteolíticas alrededor de los dientes, pérdida de las criptas y de la lámina dura, desplazamiento de gérmenes dentarios, ensanchamiento del folículo y la aparición de "dientes flotantes" en lesiones más grandes. En ocasiones puede observarse la reabsorción radicular de los dientes sumergidos o en contacto con la neoplasia. El crecimiento subperióstico del linfoma suele dar una imagen en "rayos de sol", hallazgo que nos obliga a hacer el diagnóstico diferencial con otros tumores de los maxilares. A nivel del maxilar superior se han descrito casos en los que aprecia el borramiento del reborde del seno maxilar. Varios autores coinciden en que estas alteraciones radiológicas pueden ser detectadas antes de que se presente cualquier signo o síntoma clínico (sobre todo en la variante endémica), hecho que permitiría hacer un diagnóstico precoz (9, 27, 32, 36) (Figura 3). 3.2. Tomografía computadorizada y tomografía por emisión de positrones La tomografía computadorizada (TC) permite hacer exploraciones radiográficas de diferentes zonas anatómicas siendo de gran utilidad para el estudio de la extensión del tumor. En la región bucofacial, permite conocer la extensión tumoral y la relación y posible afectación de estructuras anatómicas de suma importancia como son los grandes vasos sanguíneos y los diferentes espacios anatómicos o otras estructuras cercanas (26). La tomografía por emisión de positrones (PET) es una técnica de medicina nuclear en la que se utiliza 18F-fluorodesoxiglucosa como trazador radioactivo. Este trazador tiene una alta sensibilidad pero no una especificidad absoluta para los linfomas. Por tanto, al no ser un marcador tumoral específico puede dar falsos positivos. Es interesante utilizar la TC combinada con la PET, ya que de esta forma se obtienen un diagnóstico más preciso al permitir identificar zonas no tumorales marcadas por el trazador (33, 37, 38). La PET permite la valoración del paciente con LB en los diferentes estadios del tratamiento y los resultados negativos de la PET van siempre asociados a evoluciones favorables de la enfermedad por lo que podríamos utilizarla como valor pronóstico (39). 4. OTRAS PRUEBAS COMPLEMENTARIAS Otras pruebas complementarias que se pueden realizar para el diagnóstico del LB son la analítica sanguínea y la biopsia. 4.1. Analítica sanguínea Los pacientes con LB pueden presentar una serie de alteraciones no específicas en el hemograma. Entre ellas destacan la anemia (normocítica y normocrómica), la trombocitopenia, las alteraciones de la fórmula leucocitaria y los bajos niveles de los reticulocitos. El hematocrito y la hemoglobina suelen presentar valores ligeramente más bajos en comparación a los valores estándar. Por otro lado, encontraremos aumentados, la velocidad de sedimentación globular (VSG), el ácido úrico, la transaminasa sérica glutámico-oxalacética (SGOT), la enzima fosfatasa alcalina y ciertas inmunoglobulinas. Algunos autores opinan que los niveles de deshidrogenasa láctica (LDH) se encuentran patognomónicamente elevados. Este dato es importante ya que los niveles de LDH están correlacionados con el tamaño del tumor, y por tanto son útiles como valor pronóstico (valores muy elevados son indicativos de un mal pronóstico). Se ha comprobado que cuando se reduce el tamaño del tumor mediante cirugía, los niveles de LDH disminuyen considerablemente. Algunos autores añaden que los niveles de ferritina también pueden ser indicativos del tamaño del tumor (13, 21, 40). Incluiremos en este apartado los anticuerpos de la malaria y el VEB. Los niveles altos de anticuerpos anti-malaria y de anticuerpos frente el VEB parecen estar relacionados con una mayor incidencia del LB endémico. Se cree que el virus y el parásito actúan de forma sinérgica, ya que se ha comprobado que cuando se encuentran en solitario no se ve aumentada la prevalencia de la enfermedad. Otros estudios refieren que el 95% de los pacientes con LB endémico presentan infección por el VEB y que existe una estrecha relación entre VEB y el LB. El mecanismo de actuación no está claro, existiendo diversas hipótesis. La más extendida apoya que el paludismo o la malaria (siendo el parásito Plasmodium falciparum causante de la enfermedad) conduciría a la reactivación de los linfocitos B, los cuales podrían ser infectados por el VEB suprimiendo las células T específicas anti-VEB. Hay estudios que remarcan que no hay que atribuir este hecho a la malaria sino a otros factores como parásitos intestinales que coexisten en zonas de distribución del paludismo (11, 13, 22, 40-42). 4.2. Biopsia y estudio anatomopatológico La biopsia incisional es la prueba diagnóstica que nos dará el diagnóstico de certeza y por tanto es la prueba complementaria más importante. Cuando incluyamos en el diagnóstico diferencial el LB deberemos informar al patólogo para que no confunda la neoplasia con un trastorno linfoproliferativo benigno (1, 2, 30). Anatomopatológicamente la biopsia excisional ganglionar muestra una proliferación difusa de células medianas no hendidas, entre las cuales pueden intercalarse histiocitos con restos celulares en su interior (grasa y restos nucleares desintegrados o degenerados) lo que produce áreas claras en un contenido de linfocitos, dando una imagen descrita como en "cielo estrellado" (9, 21, 34, 40). Con una muestra del tejido extirpado se debe hacer un estudio inmunohistoquímico, imprescindible hoy en día para el diagnóstico de certeza del LB. La inmunohistoquímica consiste en la aplicación de un anticuerpo dirigido específicamente contra el antígeno que queramos demostrar y un sistema de visualización que permita detectar si ha habido fijación del anticuerpo al tejido. Los antígenos específicos de las células de la línea B son CD20, CD19, CD79a y CD10 y por lo tanto serán positivos en el estudio inmunohistoquímico del LB. Otros antígenos como Bcl-2 (proteína inducida por oncógenes) y TdT (deoxirribonucleotidil transferasa terminal) deberán ser negativos para la muestra de la biopsia y el antígeno Ki-67 (proteína relacionada con la proliferación) será positivo para cualquier tumor (24, 27, 43-45). En los países en vías de desarrollo, el estudio inmunohistoquímico se reserva a los casos complejos, siendo la tinción con hematoxilina-eosina la prueba complementaria por excelencia por su menor coste económico. Hay varios estudios que han valorado la sensibilidad y la especificad de la tinción para el diagnóstico del LB obteniendo unos resultados del 76,6 al 93,2% y de 50 al 92,7% respectivamente (34, 44, 46, 47). El análisis genético se reserva para los casos más complejos en los que el diagnóstico es muy difícil. El LB en la mayoría de los casos presenta una translocación del cromosoma 8 al 14 (q24;q32) que afecta al protooncogen c-myc. Esta translocación es capaz de inducir la proliferación rápida de células malignas tipo B. En las biopsias de LB se detectan niveles elevados de expresión de este gen, hecho que permite utilizar la técnica para el diagnóstico del linfoma. Sin embargo estudios recientes mencionan si este gen también se expresa en otros linfomas de células B y que por tanto no presenta tanta especificidad como se le había atribuido (22, 27, 35, 48-50). 5. PRONÓSTICO En general presenta una evolución aguda o subaguda. La afectación del estado general se establece en un periodo corto, presentándose fiebre, astenia, dolor abdominal y cuadros obstructivos intestinales. En la mitad de los casos la primera manifestación clínica es una inflamación en el maxilar (superior y/o inferior) que se confunde con un absceso que no remite con antibióticos (22). El pronóstico depende de la extensión de la enfermedad, de la edad del paciente y del momento del diagnóstico. Es excelente en los niños, donde la tasa de supervivencia alcanza casi el 100% de los casos, y la ausencia de morbilidad se sitúa entre el 75 y 85% de los casos. Los adultos no son tan afortunados, ya que su tasa de supervivencia se sitúa entre el 50 y el 75%, debido a que la mayoría de estos pacientes están afectados por el S.I.D.A (30, 52). La tasa de supervivencia puede ser más baja si la neoplasia se extiende a la médula ósea u a otros órganos, siendo más favorable cuando se diagnostica en etapas tempranas (30, 52). Los pacientes que tienen el tumor localizado exclusivamente en la región de cabeza y cuello presentan una tasa de supervivencia mayor (53). En estadios iniciales el LB endémico presenta mejor pronóstico que el LB esporádico, mientras que en casos avanzados es el LB esporádico el que evidencia mayores índices de supervivencia (4, 10). Más de la mitad de los pacientes con LB se pueden curar con quimioterapia intensiva, aunque sin el tratamiento adecuado el tiempo de supervivencia es inferior a 6 meses (2, 53, 54). 6. TRATAMIENTO El LB tiene una rápida progresión, lo que hace muy urgente su tratamiento. Siempre debe efectuarse una cuidada historia clínica, un examen físico completo junto al estudio de la función renal; realizando tomografías y ultrasonografía abdominal para observar la localización del tumor y vigilar la respuesta al tratamiento (2, 55). El tratamiento de elección es la quimioterapia intensiva y de corta duración, con la que el 80 al 90% de los niños y adolescentes se pueden curar. El tratamiento se debe iniciar rápidamente, debido a la rápida progresión tumoral, para evitar problemas obstructivos intestinales o hemorrágicos. La cirugía y la radioterapia quedan en un segundo plano. La cirugía debe utilizarse como método diagnóstico y no para practicar grandes resecciones tumorales. La quimioterapia consiste en la administración de dosis intensivas de ciclofosfamida (que puede alternarse con ifosfamida) en combinación con otros agentes activos (especialmente metotrexato, vincristina, antraciclínicos y citarabina), durante 4 meses. Los excelentes resultados obtenidos utilizando los ciclos de quimioterapia hacen que no esté indicado el transplante autólogo de células progenitoras hematopoyéticas en la primera remisión completa. Los pacientes antes considerados de mal pronóstico (edad inferior a los 15 años, LDH elevada o compromiso de la médula ósea o el sistema nervioso central) han incrementado su tasa de supervivencia al 70-80% a los 4 años. Las recidivas suelen ocurrir antes de los 6 meses y su tasa de supervivencia es del 10-20% a los 5 años. La terapia antirretroviral también es utilizada en el tratamiento de estos pacientes, sobre todo los que presentan estados de inmunodeficiencia asociados (18, 51, 56, 57) (Figura 4). Los pacientes sensibles a la quimioterapia de rescate deben tratarse con altas dosis de quimioterapia ablativa y con trasplante autólogo de células hematopoyéticas, con lo que se logra una supervivencia libre de enfermedad superior al 50%. Los pacientes primariamente refractarios al tratamiento o que presentan recidivas no quimiosensibles tienen mal pronóstico y en ellos el autotransplante tampoco es eficaz (24, 40). Los pacientes con LB endémico que viven en África ecuatorial tienen pocas posibilidades de acceder a tratamientos modernos. Un estudio reciente mostró que el empleo de uno o más ciclos con sólo ciclofosfamida logró el 63% de tasa de supervivencia en niños cuya enfermedad estaba limitada a la cabeza y del 33% cuando además se afectaban otras localizaciones (31, 40, 58). Cabe destacar, que en los casos donde la respuesta al tratamiento es adecuada las manifestaciones bucales desaparecen. El tratamiento bucodental se enfoca a controlar de forma paliativa los efectos secundarios de la quimioterapia, siendo la mucositis la más representativa (59). CONCLUSIONES El papel del odontólogo ante el diagnóstico precoz del LB es muy importante, ya que la tasa de supervivencia aumenta de forma significativa en los pacientes donde el diagnóstico se efectúa de forma precoz. Los dentistas deben sospechar esta patología cuando se enfrentan con un paciente pediátrico con hipermovilidad dentaria, supra-erupción de los dientes permanentes y con una reabsorción del hueso alveolar grave alrededor de estos, en los que no exista una etiología que justifique la clínica. La parestesia inexplicable del nervio dentario inferior debe ser también inquietante. Cuando alguno de estos síntomas o signos se presenta, el odontólogo debe tener un alto índice de sospecha y actuar con prontitud. El tratamiento de éstos pacientes de forma inadecuada puede conducir rápidamente a consecuencias desastrosas como el fallecimiento del paciente, mientras que si hacemos un diagnóstico y tratamiento precoces el índice de supervivencia es muy alto. Por este motivo, es importante aprender a identificar cualquier patología con repercusión bucal ya que de nosotros depende hacer un diagnóstico precoz correcto, y por tanto aumentar la tasa de supervivencia de los pacientes con esta enfermedad. AGRADECIMIENTOS Este estudio ha sido realizado por el grupo de investigación consolidado "Patología y Terapéutica Odontológica y Maxilofacial" del Institut d'Investigació Biomèdica de Bellvitge (IDIBELL) con el soporte económico del convenio docente-asistencial de Cirugía Bucal entre la Universidad de Barcelona, el Consorci Sanitari Integral y el Servei Català de la Salut de la Generalitat de Catalunya. 
BIBLIOGRAFÍA - Ceballos H, Martagón LR. Linfoma de Burkitt con repercusión estomatológica. Informe de un caso. Acta Pediatr Mex. 2005;26:67-70.
- Cruz O, San Román M, Villaronga M. Burkitt's lymphoma in Africa. Management and treatment. Acta Pediatr Mex. 2005;24:35-7.
- Hasserjian R, Ott G, Elenitoba-Johnson K, Balague-Ponz O, de Jong D, de Leval L. Commentary of the WHO Classification of tumors of lymphoid tissues (2008): "Gray zone" lymphomas overlapping with Burkitt lymphoma or classical Hodgkin lymphoma. J Hematopathol. 2009;2:89-95.
- García FJ, Morant A, Tormos MM, Algarra JM. Disfagia alta por linfoma de Burkitt de amígdala lingual resistente a quimioterapia. Acta Otorrinolaringol Esp. 2003;54:109-12.
- Pereira CM, Lopes AP, Meneghini AJ, Silva GB, Monteiro MC, Botelho T. Burkitt's lymphoma in a young Brazilian boy. Malays J Pathol. 2010;32:59-64.
- Coakley D. Denis Burkitt and his contribution to haematology/oncology. Br J Haematol. 2006;135.17-25.
- Cruz O, San Román M, Villaronga M. Burkitt's lymphoma in Africa. Acta Pediatr Mex. 2005;26:70-72.
- Balasubramaniam R, Goradia A, Turner LN, Stoopler ET, Alawi F, Frank DM et al. Burkitt lymphoma of the oral cavity: An atypical presentation. Oral Surg Oral Med Oral Pathol Oral radiol Endod. 2009;107:240-5.
- Gay-Escoda C, Lu-Cortés L, Rodríguez J, Girons S, Guiu M. Linfoma de Burkitt: A propósito de dos casos. Rev Esp Cir Oral Maxilofac. 1982;9:19-28.
- Koffi GK, Tolo A, Nanho DC, N'Dathz E, Kouassi MY, N'Diaye FD et al. Results of treatment with CMA, a low intermediate regimen, in endemic Burkitt lymphomas in sub-Saharian Africa: Experience of Cote d'Ivoire. Int J Hematol. 2010; 91:838-43.
- Ogwang MD, Bathia K, Biggar RJ, Mbulaiteye Sm. Incidence and geographic distribution of endemic Burkitt lymphoma in northern Uganda revisited. Int J Cancer. 2008;123:2658-63.
- Kalungi S, Wabinga H, Molven A, Bostad L. Lymphomas diagnosed in Uganda during the HIV/AIDS pandemic. East Afr Med J. 2009;86:226-32.
- Carpenter LM, Newton R, Casabonne D, Ziegler J, Mbulaiteye S, Mbidde E et al.. Antibodies against malaria and Epstein-Barr virus in childhood Burkitt lymphoma: A case-control study in Uganda. Int J Cancer. 2008;122:1319-23.
- Queiroga EM, Gualco G, Chioato L, Harrington WJ, Araujo I, Weiss LM et al. Viral studies in Burkitt's lymphoma: Association with Epstein-Barr virus but not HHV-8. Am J Clin Pathol. 2008;130:186-92.
- Tumwine LK, Orem J, Kerchan P, Byarugaba W, Pileri SA. EBV, HHV8 and HIV in B cell non Hodgkin lymphoma in kampala, Uganda. Infect Agent Cancer. 2010;5:12-9.
- Cader FZ, Kearns P, Young L, Murray P, Vockerodt M. The contribution of the Epstein-Barr virus to the pathogenesis of childhood lymphomas. Cancer Treat Rev. 2010;36:348-53.
- Chene A, Donati D, Orem J, Mbidde ER, Kironde F, Wahlgren M et al. Endemic Burkitt's lymphoma as a polimicrobial disease: New insights on the interaction between Plasmodium falciparum and Epstein-Barr virus. Semin Cancer Biol. 2009;19:411-20.
- Kelemen K, Braziel RM, Gatter K, Bakke TC, Olson S, Fan G. Inmunophenotypic variations of Burkitt lymphoma. Am J Clin Pathol. 2010;134:127-38.
- Seegmeller AC, García R, Huang R, Maleki A, Karandikar NJ, Chen W. Simple Karyotype and bcl-6 expression predict a diagnosis of Burkitt lymphoma and better survival in IG-MYC rearranged high-grade B-cell lymphomas. Mod Pathol. 2010;23:909-20.
- Mwanda OW. Clinical characteristics of Burkitt's lymphoma seen in Kenyan patients. East Afr Med J. 2004;8:78-89.
- Svoboda WE, Aaron GR, Albano EA. North American Burkitt's lymphoma presenting with intraoral symptoms. Pediatric Dentistry 1991;13:52-8.
- Orem J, Mbidde EK, Lambert B, de Sanjose S, Weiderpass E. Burkitt's lymphoma in Africa, a review of the epidemiology and etiology. Afr Health Sci. 2007;7:166-75.
- Mwakigonja AR, Kaaya EE, Mgaya EM. Malignant lymphoma's (ML) and HIV infection in Tanzania. J Exp Cancer Res. 2008;10:27-9.
- Mwanda OW, Rochford R, Moormann AM, Macneil A, Whalen C, Wilson ML. Burkitt's lymphoma in Kenya: Geographical, age, gender and ethnic distribution. East Afr Med J. 2004;8:68-77.
- Comfort AO. Burkitt's lymphoma of the jaws: Role of dental practitioner in management. Pac Health Dialog. 2004;11:89-93.
- Ugar DA, Bozkaya S, Karaca I, Tokman B, Pinarli FG. Childhood craniofacial Burkitt's lymphoma presenting as maxillary swelling: Report of a case and review of literature. J Dent Child (Chic). 2006;73:45-50.
- Tsui SH, Wong MH, Lam WY. Burkitt's lymphoma presenting as mandibular swelling, report of a case and review of publications.Br J Oral Maxillofac Surg. 2000;38:8-11.
- Landesberg R, Yee H, Datikashvili M, Ahmed AN. Unilateral mandibular lip anesthesia as the sole presenting symptom of Burkitt's lymphoma: Case report and review of literature. J Oral Maxillofac Surg. 2001;59:322-6.
- Zhou Q, Leng DN, Zhang ZX, Zhou HB, Shi OL, Zhou XJ. Burkitt's lymphoma of the spermatic cord: A case report and review of the literature. Zhonghua Nan Ke Xue. 2008;14:624-7.
- Rasper M, Kesari S. Burkitt's lymphoma presenting as a rapidly evolving cavernous sinus syndrome. Arch Neurol. 2008;65:1668.
- Freitas R, Barros S, Quindere L. Oral Burkitt's lymphoma: Case report. Rev Bras Otorrinolaringol. 2008; 74: 458-61.
- Liu RS, Liu HC, Bu JQ, Dong SN. Burkitt's lymphoma presenting with jaw lesions. J Periodontol. 2000;71:646-9
- Kazama T, Faria SC, Varavithya V, Phongkitkarun S, Ito H, Macapinlac HA. FDG PET in the evaluation of treatment for lymphoma: Clinical usefulness and pitfalls. Radiographics. 2005;25:191-207.
- Tumwine LK, Wabinga H, Odida M. Haematoxylin and eosin staining in the diagnosis of Hodgkin's disease in Uganda. East Afr Med J. 2003;80:119-23.
- Dave SS, Fu K, Wright GW, Lam LT, Kluin P, Boerma EJ et al. Molecular diagnosis of Burkitt's lymphoma. N Engl J Med. 2006;354:2431-42
- Nortjé CJ. General practitioner's radiology case 63. Burkitt's lymphoma. SADJ. 2008;63:248-50.
- Castellucci P, Zinzani P, Pourdehnad M, Alinari L, Nanni C, Farsad M et al. 18F-FDG PET in malignant lymphoma: Significance of positive findings. Eur J Nucl Med Mol Imaging. 2005;32:749-56.
- Castellucci P, Nanni C, Farsad M, Alinari L, Zinzani P, Stefoni V et al. Potential pitfalls of 18F-FDG PET in a large series of patients treated for malignant lymphoma: Prevalence and scan interpretation. Nucl Med Commun. 2005;26:689-94.
- Just PA, Fieschi C, Baillet G, Galicier L, Oksenhendler E, Moretti JL. 18F-fluorodeoxyglucose positron emission tomography/computed tomography in AIDS-related Burkitt's lymphoma. AIDS Patient Care STDS. 2008;22:695-700.
- Ferreras R. Tratado de medicina interna. 15 ed. Madrid: Elsevier; 2004.
- Njie R, Bell AI, Jia H, Croom-Carter D, Chaganti S, Hislop AD. The effects of acute Malaria on Ebstein-Barr virus (EBV) load and EBV-especific T cell Immunity in Gambian Children. J Infect Dis. 2009;199:31-8.
- Watanabe A, Maruo S, Ito T, Ito M, Katsumura KR, Takada K. Epstein-Barr virus-encoded Bcl-2 homologue functions as a survival factor in Wp-restricted Burkitt lymphoma cell line P3HR-1. J Virol. 2010; 84:2893-901.
- Ordi J. Anatomía patológica general. Barcelona: Editorial Universidad de Barcelona; 2006.
- Lukande R, Wabinga HR, Tumwine LK. Burkitt's lymphoma in Uganda: The role of immunohistochemistry in diagnosis. East Afr Med J. 2008;85:207-12.
- Mesquita RA, de Araújo VC, Paes RA, Nunes FD, de Souza SC. Immunohistochemical analysis for CD21, CD35, Caldesmon and S100 protein on dendritic cells types in oral lymphomas. J Appl Oral Sci. 2009;17:248-53.
- Tumwine LK. Immunohistochemical analysis of Hodgkin's disease in Kampala, Uganda. East Afr Med J. 2004;81:34-7.
- Pazoki A, Jansisyanont P, Ord RA. Primary non-Hodgkin's lymphoma of the jaws: Report of 4 cases and review o the literature. J Oral Maxillofac Surg. 2003;61:112-7
- Manolopoulos L, Nikolopoulos TP, Yiotakis J, Karapatsas J, Maris A, Ferekdis E. Burkitt's lymphoma in the base of the tongue: Differential diagnosis and management. ORL. 2003;65:226-9
- Gupta H, Davidoff AM, Pui CH, Schochat SJ, Sandlund JT. Clinical implications and surgical management of intussusception in pediatric patients with Burkitt lymphoma. J Pediatric Surg. 2007,42:998-1001
- De Larrinoa AF, del Cura J, Zabala R, Fuertes E, Bilbao F, Lopez JI. Value of ultrasound-guided core biopsy in the diagnosis of malignant lymphoma. J Clin Ultrasound. 2007;35:295-301
- Tang W, Harmon P, Gulley ML, Mwansambo C, Kazembe PN, Martinosn F et al. Viral response to chemotherapy in endemic Burkitt lymphoma. Clin Cancer Res. 2010;16: 2055-64.
- Yustein JT, Dang CV. Biology and treatment of Burkitt's lymphoma. Curr Opin Hematol. 2007;14:375-81.
- Kazembe P, Hesseling PB, Griffin BE, Lampert I, Wessels G. Long term survival of children with Burkitt lymphoma in Malawi after cyclophosphamide monotherapy. Med Pediatr Oncol. 2003;40:23-5.
- Jan A, Vora K, Sándor GK. Sporadic Burkitt's lymphoma of the jaws: The essentials of prompt life-saving feral and management. J Can Dent Assoc. 2005;71:165-8.
- Kenkre VP, Stock W. Burkitt lymphoma/leukemia: Improving prognosis. Clin Lymphoma Myeloma. 2009;9:231-8
- Mantina H, Wiggill TM, Carmona S, Perner Y, Stevens WS. Characterization of lymphomas in a high prevalence HIV setting. J Acquir Immune Defic Syndr. 2010;53:656-60.
- Tumwine LK, Agostinelli C, Campidelli C, Othieno E, Wabinga H, Righi S et al. Inmunohistochemical and other prognostic factors in B cell non Hodgkin lymphoma patients, Kampala. BMC Clin Pathol. 2009;16:9-11.
- Aldoss IT, Weisenburger DD, Fu K, Chan WC, Vose JM, Bierman PJ. Adult Burkitt lymphoma: Advances in diagnosis and treatment. Oncology. 2008;22:1508-17.
- Hoelzer D. Update on Burkitt lymphoma and leukemia. Clin Adv Hematol Oncol. 2009;7:728-9.
|
 Información General
Información General Artículos
Artículos Notícias
Notícias Enlaces
Enlaces Contactar
Contactar Buscar
Buscar Premio Nadal
Premio Nadal Formación Continuada
Formación Continuada
