El Prostodoncista frente a la Periimplantitis |
||||||||||||||||||||||||||||||||||||||||||||||
Publicado el: 19/07/2007 10:24:27 | ||||||||||||||||||||||||||||||||||||||||||||||
Autores: Correspondencia: Campus de Bellvitge. C/Feixa Llarga s/n. L’Hospitalet de Llobregat. 08907. Barcelona. E-mail: luciacamps@hotmail.com Teléfono: 934024286 Pese a la predictibilidad a largo plazo de los implantes oseointegrados, en un porcentaje pequeño de casos ocurren complicaciones como es la pérdida del implante. Estas pérdidas se han atribuido a diferentes causas tales como trauma quirúrgico, infección, sobrecarga y ciertas condiciones locales y sistémicas. Se denomina periimplantitis a la pérdida ósea periimplantaria progresiva junto con una lesión inflamatoria de los tejidos blandos. La periimplantitis es la responsable del 10-50% de los fracasos en implantes en el primer año de carga. Se han propuesto como factores etiológicos de la periimplantitis la colonización bacteriana, la existencia de trauma oclusal, factores sistémicos del huésped y factores relativos a la fijación, los cuales revisamos más concretamente, así como las pruebas diagnósticas existentes y los distintos protocolos de actuación propuestos en la literatura. De la revisión realizada parece clara la etiología bacteriana de la periimplantitis y disponemos de pruebas diagnósticas fiables pero no hay evidencia que permita establecer un protocolo cierto para su tratamiento. PALABRAS CLAVE: Periimplantitis, implantes, flora bacteriana. INTRODUCCIÓN Durante las últimas décadas, los implantes dentales se han convertido en la mejor alternativa a la prótesis removible en los casos en los que la prótesis fija dentosoportada no es factible. Multitud de estudios reportan tasas de supervivencia de los implantes oseointegrados entre 90-95% en periodos de más de 10 años1. Sin embargo, pese a la predictibilidad a largo plazo de los implantes oseointegrados, en un porcentaje pequeño de casos ocurren complicaciones. La pérdida del implante se puede clasificar en “temprana”, si se produce antes de la carga funcional; o “tardía”, si se produce tras la carga funcional 2,3,4. Estas pérdidas se han atribuido a diferentes causas, tales como trauma quirúrgico, infección, sobrecarga y ciertas condiciones locales y sistémicas1. Se denomina periimplantitis a la pérdida ósea periimplantaria progresiva junto con una lesión inflamatoria de los tejidos blandos5. (Figura 1).
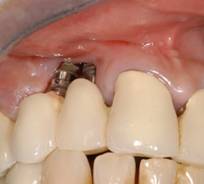 Figura 1. Imagen clínica de periimplantitis.
Los tejidos blandos clínicamente sanos junto a dientes e implantes presentan color rosado y consistencia firme. Existen también varios rasgos microscópicos comunes. Ambas unidades tisulares están tapizadas por epitelio bucal bien queratinizado que se continua con un epitelio de unión de unos 2mm de largo. El epitelio está separado del hueso alveolar por una zona de tejido conectivo >1mm de altura. Estos tejidos periimplantarios se diferencian de los periodontales en su distribución y composición. En los implantes, las fibras colágenas de la mucosa en el tejido supraalveolar revisten el periostio en la cresta ósea y se proyectan en todas las direcciones paralelas a la superficie del implante o se alinean como haces gruesos que siguen un curso más o menos paralelo a la superficie del hueso8. Un análisis integral de la composición de los dos compartimentos de tejido conectivo reveló que la mucosa periimplantar contenía más colágeno (85%) y menos fibroblastos (1-3%) que las regiones correspondientes en la encía peridental. Es decir, la mucosa periimplantar en la interfase de tejido conectivo y titanio tenía las características de un tejido cicatricial, rico en colágeno y con pocas células8. En cuanto al aporte vascular, el sitio del implante carece de ligamento periodontal y, por tanto, de un plexo ligamentario9. Se observó que el sistema vascular de la mucosa periimplantar se origina únicamente en un gran vaso sanguíneo supraperióstico por fuera del reborde alveolar. Este vaso da ramas para formar un plexo de capilares y vénulas por debajo del epitelio bucal y el de unión8,9. Las fuerzas provocadas por los contactos oclusales tanto funcionales como parafuncionales sobre dientes naturales resultan en una adaptación fisiológica del periodonto, siempre que no superen la capacidad adaptativa del paciente, en cuyo caso derivaran en un traumatismo oclusal. En el caso de los implantes oseointegrados no existe ligamento periodontal, lo que disminuye esta capacidad adaptativa a la carga oclusal 10. Aunque la pérdida de integración debida a fuerzas oclusales no se descarta, no se ha establecido evidencia científica para dicha afirmación. La relación entre la acumulación de placa bacteriana y la gingivitis y periodontitis está bien establecida, así como la actuación como co-factor de trauma oclusal. Esta afirmación no ha sido totalmente demostrada en el caso de los implantes. Como prostodoncistas, ante un caso de periimplantitis nos encontramos en la problemática de establecer la etiología real del proceso para tratar la patología de la forma más acertada. Vistas las características de esta zona periimplantar y con el objetivo de profundizar en el conocimiento de la etiología, diagnóstico y tratamiento de la enfermedad periimplataria, presentamos esta revisión de la literatura, a nuestro alcance disponible sobre el tema. ETIOLOGÍA Por razones éticas no se pueden llevar a cabo estudios experimentales de la periimplantitis sobre humanos. La información al respecto debe ser recogida en estudios retrospectivos o experimentales sobre animales. Se han propuesto como factores etiológicos de la periimplantitis la colonización bacteriana, la existencia de trauma oclusal, factores sistémicos del huésped y factores relativos a la fijación, los cuales revisamos más concretamente. Factores Bacterianos
 Figura 2. Colonización bacteriana de la superficie
La relación entre la acumulación de placa bacteriana y la gingivitis y periodontitis está bien establecida. Estudios sobre perros beagle3,11 demuestran que bajo la acumulación de placa provocada por ligaduras de hilo de algodón, tanto dientes como implantes desarrollan una inflamación. Si esta lesión se limita a tejido blando (gingivitis o mucositis periimplantar) es totalmente reversible en ambos casos. Por el contrario, si la lesión afecta a más tejidos de sostén, la lesión se hace irreversible. Se han aislado ciertas bacterias en cantidades significantes de los lechos periodontales que no aparecen en lechos sanos; se les ha llamado bacterias periodontopáticas12. Mientras que el fracaso de un implante no se ha asociado a la presencia de ningún microorganismo concreto, las mismas bacterias que se han asociado con la enfermedad periodontal están frecuentemente presentes alrededor de implantes fracasados13,14,15. Además de las cepas de bacterias anaeróbicas gram negativas, se han asociado otras especies en la infección periimplantaria como Bacteroides forsythus, Fusobacterium nucleatum, Camphylobacter, Peptostreptococcus micros y Streptococcus intermedius16. Sin embargo, la presencia de bacterias periodontopáticas alrededor de los implantes no es en si mismo un indicador de periimplantitis12,13,17. Aunque el perfil microbiológico de los implantes fracasados difiere de la observada en implantes sanos, no se conoce si el papel del huésped en la resistencia a esta infección es similar al presente en la periodontitis18. La colonización microbiana alrededor de los implantes está influenciada por la población microbiana de la cavidad oral. Mombelli et al19 en un estudio de los implantes colocados en pacientes con historia de enfermedad periodontal previa encontraron que la microflora presente en la cavidad oral antes de la colocación de los implantes determinaba la composición de la microflora encontrada en los implantes colocados13,19. En pacientes totalmente edéntulos la microflora adyacente a los implantes es similar en tipo a la de la mucosa adyacente, que es, por naturaleza, no particularmente periodontopática. Predominan las bacterias facultativas Gram positivo 13,20. En pacientes parcialmente edéntulos la microflora adyacente a los implantes es la misma que la que coloniza la dentición natural 13,19,21. Se encuentra un alto porcentaje de P.gingivalis, P.intermedia y A.Actinomycetemcomitans 18. Así, los dientes naturales, si presentan colonias de organismos patógenos suponen un reservorio para iniciar la infección bacteriana alrededor de los implantes 13,20,22,23,24,25. En estudios de las bacterias alrededor de implantes y dientes se encontraron diferencias en la composición microbiana en pacientes con historia de periodontitis o periimplantitis, incluso cuando la enfermedad no estaba activa. Estos pacientes parecen tener una mayor susceptibilidad al crecimiento de estos organismos 19,23. Se ha establecido que la microbiota asociada con tejidos periimplantarios sanos o mucositis es equivalente a la microbiota asociada a salud gingival o gingivitis. Por otro lado, la microbiota identificada en infecciones periimplantarias es casi idéntica a la encontrada en las bolsas periodontales 10. Factores Oclusales Los dientes naturales están soportados por el ligamento periodontal con receptores que ayudan a proteger los dientes y el periodonto de fuerzas oclusales que puedan causar trauma del hueso de soporte 13,26. Estos reflejos neuromusculares no existen en los implantes osteointegrados. Clínicamente, una oclusión poco acertada en una restauración implantosoportada puede tener un efecto de deterioro del hueso de soporte así como de los componentes de la prótesis 27. Lindquist et al28 en un estudio que evalúa los efectos de las fuerzas oclusales sobre implantes oseointegrados, indica que la sobrecarga oclusal es la primera causa de pérdida ósea alrededor de los implantes. Lundgren y Laurell en 198429, al describir las fuerzas oclusales sugieren la necesidad de minimizar fuerzas horizontales causadas por contactos prematuros o cúspides pronunciadas. Isidor, en un estudio de 199630, demostró, sobre animales, la pérdida ósea alrededor de implantes sujetos a fuerzas excesivas no axiales. Así, el esquema oclusal para una restauración implantosoportada debería ser diseñado disminuyendo las interferencias cuspídeas, centralizando las fuerzas en el eje axial de los implantes, y minimizando las fuerzas laterales31. En un estudio retrospectivo realizado por Chung y cols en 20074, se concluye también que las restauraciones fijas tienen un mayor grado de pérdida ósea periimplantaria respecto a las restauraciones removibles. Edad del paciente Estudios como los de Bryant y Zarb32 respecto al tratamiento con implantes en pacientes jóvenes o adultos, no encuentran contraindicaciones para su uso en pacientes ancianos. Sin embargo, cuanto mayor es el paciente, peores condiciones óseas locales. Aunque el proceso de integración en si no se ve comprometido por el aumento de la edad del paciente; teóricamente, necesitará más tiempo para la osteointegración, más tiempo para la adaptación a la prótesis y su capacidad para mantener la higiene será peor13,32,33. Género En ausencia de otros factores sistémicos, no se ha demostrado que el género del paciente sea un factor que determine el fracaso del implante 13,34. Tabaco Lindquist et al 35 mostraron que el control de placa alrededor del implante no era un factor significativo en la pérdida ósea a menos que el paciente fuera fumador. También encontraron que a mayor cantidad de tabaco, mayor la pérdida ósea; pero incluso con esta mayor pérdida ósea de los fumadores, los no fumadores también perdían implantes durante el estudio35. El consumo de tabaco se asocia con mayor índice de mucositis, mayor pérdida de nivel óseo y periimplantitis 36,37. Un estudio de Brain y Moy38 en 1993 reveló que la pérdida de implantes en pacientes fumadores era 2.4 veces mayor que en no fumadores. Karoussis y co39 observaron que el nivel óseo marginal del implante en 10 años estaba estadísticamente asociado con el factor tabaco. Superficie del implante Las características de la superficie del implante pueden influir en la colonización bacteriana. Una mayor rugosidad de una superficie proporciona, potencialmente, una mejor matriz sobre la cual las bacterias pueden crecer y encontrar mayor protección del arrastre de la saliva y de la autoclisis. Cuanto más liso es un implante, mayor la dificultad de las bacterias para adherirse a él13,40. La observación al microscopio electrónico de barrido reveló que la colonización inicial de las superficies duras intraorales se inicia en las irregularidades superficiales. Además, la superficie rugosa incrementa el área disponible para la adhesión por un factor >X312. Un metanálisis realizado en 2005 atribuye un 20% más de afección periimplantaria a los implantes de superficie rugosa respecto a los de superficie lisa41. Chung y cols4 en 2007 en un estudio retrospectivo, no encontraron diferencias significativas en el nivel óseo marginal del implante analizando diferentes configuraciones de superficie. Así mismo, ha sido documentada en numerosos estudios experimentales la necesidad de un cierto grado de rugosidad para la correcta integración del implante en el hueso 12,42,43,44,45,46. Tamaño del implante Pocos estudios dan datos sobre la influencia de este parámetro en la incidencia de enfermedad periimplantaria. En el estudio retrospectivo de Chung y cols13 2007 concluyen que los implantes más cortos y más anchos presentan una mayor pérdida de hueso marginal respecto a sus antónimos. Consideran la longitud del implante como el factor más crítico. Ajuste pasivo de los componentes del implante Asumimos que la falta de ajuste de las restauraciones implantosoportadas puede transferir estrés a la interfase hueso-implante produciendo la pérdida del implante13,47,48,49. Sin embargo, estudios diseñados para observar los efectos del grado de desajuste en las restauraciones implantosoportadas han sido incapaces de demostrar el efecto negativo del desajuste en esta área13,47,50,51,52. No parece haber consenso en el grado de desajuste tolerable a largo plazo en los implantes. Sin embargo, la incidencia de pérdida de tornillos aumenta si la prótesis no presenta ajuste pasivo53. Parece prudente, pues, la fabricación de prótesis que ajusten lo más pasivamente posible. DIAGNÓSTICO Profundidad de sondaje Aunque existen opiniones respecto al daño que puede causar el sondaje al sellado periimplantario haciendo peligrar la integridad del implante, no existe evidencia científica que apoye esta idea10. La profundidad de sondaje alrededor del implante se ha propuesto que debe ser específico para cada sistema de implantes y dependiente del acceso de la sonda a la región sulcular periimplantar. Así, diferentes profundidades de sondaje deben considerarse “normales” en diferentes sistemas de implantes. Por ejemplo, para el sistema ITI, la salud de los tejidos periimplantarios se considera con un sondaje de 3-3.5mm10. Puesto que la penetración de la sonda en el tejido blando periimplantar es inhibida por el sellado fibroso, el sondaje debe considerarse como un parámetro sensible y fiable para la monitorización clínica de los tejidos blandos periimplantarios 9,10. Se recomienda establecer un valor inicial de sondaje, preferiblemente en el momento de colocar la restauración protésica, para comparar los sucesivos controles. Se aceptan 0,.2mm de pérdida ósea marginal anual como parte del proceso biológico normal 2,54. Debe tenerse en cuenta la existencia de casos en los que el acceso al surco periimplantar es impedido por la restauración protésica. En dichos casos, los parámetros a utilizar serán los restantes 9,10. Este parámetro de profundidad se considera directamente relacionado con el tipo de colonización bacteriana. A mayor profundidad de bolsa, mayor presencia de espiroquetas y microorganismos motiles22. Sangrado al sondaje Representa un parámetro clínico que se define como la presencia de sangrado tras la penetración de una sonda periondontal dentro del surco periimplantar o de la bolsa usando una presión suave. La ausencia de sangrado al sondaje es un buen indicador de estabilidad periodontal10. Aunque no existen aún datos similares para los implantes, parece lógico aplicar esta asociación al sellado de los tejidos blandos alrededor de los implantes. Así pues, desde un punto de vista clínico, la ausencia de sangrado al sondaje alrededor de los implantes indicaría salud de los mismos 10,55. Imágenes radiológicas
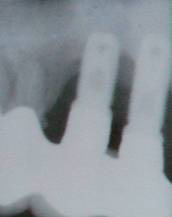 Figura 3. Imagen radiológica
Por lo mencionado, estas características limitan la función de la radiología a una prueba de confirmación, más que exploratoria (Figura 3). Sin embargo, la DIB (Distance from the Implant shoulder to the alveolar Bone crest) representa un parámetro radiográfico para la monitorización clínica a largo plazo. En las radiografías periapicales se debe usar sistemáticamente los posicionadores para disminuir al máximo los errores de proyección de imagen. Se recomiendan la técnica del cono largo y la técnica paralela. El uso de la radiología digital se incrementa la sensibilidad de las radiografías y es una prueba recomendada y aplicada con éxito en estudios longitudinales10,57. Movilidad Puesto que la infección periimplantar presenta lesiones originadas en el surco marginal periimplantar, la pérdida ósea encontrada en asociación con el desarrollo de ese tipo de infecciones también se localiza a nivel marginal y resulta en la formación de defectos intraóseos. Esto implica que el implante aún sigue oseointegrado en su porción apical y, por tanto, no se puede esperar la movilidad del implante. Por otro lado, la pérdida de estabilidad clínica como resultado de la pérdida completa de oseointegración se reflejaría en un aumento repentino de la movilidad. Así pues, el incremento de la movilidad representa un parámetro altamente específico, pero no sensible para monitorizar la estabilidad clínica10. ESTRATEGIAS DE TRATAMIENTO DESBRIDAMIENTO MECÁNICO Tratamiento básico de inicio en implantes con evidente placa o depósitos de cálculo adyacentes a tejidos periimplantarios ligeramente inflamados con sangrado al sondaje, pero sin supuración y sin exceder los 3mm de sondaje10. El cálculo se elimina usando curetas de fibra de carbono y la placa mediante el pulido de la superficie usando copas de goma y pasta de pulido. Las curetas de fibra de carbono no dañan la superficie del implante y son lo suficientemente fuertes y afiladas para eliminar los depósitos calcificados sobre el implante 10,12. Las curetas convencionales o los instrumentos ultrasónicos con puntas metálicas dejan daños sobre la superficie del implante haciéndolo mas conductivo a futuras acumulaciones de placa, así, estos instrumentos no deben ser usados 8,12,56,58. La limpieza con un sistema abrasivo de aire comprimido (p.ej. bicarbonato sódico) se ha usado en varios estudios y parece proporcionar una adecuada detoxificación que permite la nueva formación de hueso en contacto directo con la superficie del implante 10,59. Este debridamiento mecánico no proporciona un lecho estéril ni isotónico 60,61, además, existen defectos óseos estrechos mecánicamente imposibles de debridar 60. TRATAMIENTO ANTISÉPTICO Como complemento del desbridamiento mecánico, este tratamiento es efectuado en situaciones donde, además de presencia de placa y sangrado al sondaje, existen profundidades de sondaje de 4-5mm, habiendo o no supuración10. Clorhexidina El tratamiento antiséptico consiste en la aplicación de un potente antiséptico, p.ej. digluconato de clorhexidina, ya sea en forma de enjuague diario al 0.1%, 0.12% o 0.2% o aplicado en gel en la zona de lesión. Generalmente son necesarias 3-4 semanas de aplicación regular para conseguir resultados positivos10. Ácido cítrico El protocolo con la aplicación de ácido cítrico concentrado durante 2 minutos sobre la superficie del implante es el que mayor cantidad de lipopolisacáridos elimina de la superficie tratada con hidroxiapatita62. Láser Estudios in Vitro 57,58 proponen, con buenos resultados, el uso del láser Nd:YAG para la descontaminación bacteriana del implante sin daño de la superficie de titanio. Se ha demostrado en perros beagle que la descontaminación con láser de CO2 permite la esterilización del implante expuesto y su reoseointegración65. Se sugiere que la descontaminación con láser CO2 puede ser más eficaz que la convencional en defectos óseos estrechos y profundos60. Hayek y cols66 comparan el desbridamiento mecánico convencional e irrigación con clorhexidina con el uso de terapia fotodinámica con láser blando GaAlAs. No se encontraron diferencias significativas entre los grupos, y concluye que la terapia fotodinámica es un tratamiento menos invasivo e igualmente efectivo. Se ha propuesto el uso de un fotosensibilizante como el azul de toluidina antes de la terapia con láser blando. Los resultados en un estudio de 17 casos parecen satisfactorios67. TRATAMIENTO ANTIBIÓTICO Antes del inicio de este tratamiento, se deben haber realizado el desbridamiento mecánico y el tratamiento antiséptico 10,62. Cuando los valores de sondaje periimplantar incrementan 6mm o más, encontramos depósitos de placa y sangrado al sondaje. Puede existir o no supuración. La lesión es normalmente evidente radiográficamente, y la bolsa representa un nicho ecológico propicio a la colonización por bacterias anaeróbicas Gram negativo 10,20. El tratamiento antibiótico debe eliminar o, al menos, reducir los patógenos de este ecosistema submucoso. Se administrarán antibióticos dirigidos a las bacterias anaeróbicas gram negativo. Metronidazol 350mg, 3 veces al día; u orniazol 500mg, 2 veces al día20. Se reportan también casos tratados con aplicación local de fibras de tetraciclina directamente en la zona de la lesión con resultados satisfactorios62. Debemos tener en cuenta que la administración sistémica de antibióticos siempre se acompaña del riesgo de efectos adversos y la promoción de resistencias antibióticas. TERAPIA REGENERATIVA O RESECTIVA Cuando la infección se ha controlado de forma satisfactoria, con ausencia de supuración y reducción del edema, se discutirá el tratamiento apropiado para restablecer el soporte óseo del implante mediante técnicas regenerativas o remodelando la arquitectura de los tejidos periimplantarios mediante técnicas resectivas10. Se han reportado series de casos de recuperación de defectos óseos provocados por la periimplantitis mediante el uso del principio de regeneración tisular guiada (GTR) con membranas de e-PTFE 8,10,59,67. Sin embargo, la re-osteointegración de un implante previamente contaminado en hueso regenerado no se ha demostrado aún histológicamente. Además, la exposición postoperatoria de la membrana parece una complicación muy frecuente68. El tratamiento de las lesiones de periimplantitis con injertos de hueso autógeno o substitutos puede ayudar a rellenar el defecto y a mejorar las condiciones del tejido blando, aunque también se han reportado fracasos68. Factores que pueden influirán la reoseointegración del implante son: la morfología de la superficie del implante, la alteración del titanio del implante durante su descontaminación, el tipo de defecto óseo, el material de relleno, la exposición de la membrana,etc.60 EXPLANTACIÓN
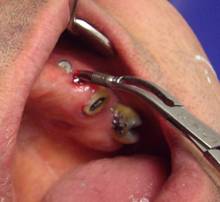 Figura 4. Explantación del implante.
Un esquema para la clasificación del caso y la selección del tratamiento es el propuesto por Mombelli en 200262 que se muestra en la tabla1.
Tabla1.
A: Debridamiento mecánico. Instrucciones de higiene oral.
De la revisión realizada parece clara la etiología bacteriana de la periimplantitis. La higiene periimplantaria constituye una conducta preventiva. La salud periodontal de los dientes remanentes, la prevención de la aparición de bolsas periimplantarias profundas así como la utilización de pilares protésicos lo más lisos posible contribuyen al correcto mantenimiento periimplantario. No hay evidencia que permita establecer un protocolo cierto para tratar la periimplantits, lo cual no significa que las intervenciones actuales no sean efectivas. Posiblemente la existencia de un protocolo de seguimiento y detección precoz de la periimplantitis ayudaría en el mantenimiento de implantes con lesión inflamatoria de tejidos blandos y su consiguiente pérdida ósea. BIBLIOGRAFÍA 1.- Esposito M, Thomsen P, Ericson LE, Sennerby L, Lekholm U. Histopatologic observations on late oral implant failures. Clin Implant Dent Relat Res. 2000;2(1):18-32. |
||||||||||||||||||||||||||||||||||||||||||||||
Publicado el: 19/07/2007 10:24:27 |
||||||||||||||||||||||||||||||||||||||||||||||