| Dubraska V. Suárez-Vega1, Gladys J. Velazco de Maldonado 2, Brenda Bautista 3, Génesis Mejía 3, Argimiro Hernandez4, Yepsis Montero5. 1. Profesor en Universidad de Los Andes. Facultad de Odontología. Magister en Ciencias Médicas. Doctorando en Facultad de Medicina ULA-Mérida, Venezuela. 2. Profesor en Universidad de Los Andes. Facultad de Odontología. Mérida-Venezuela. Doctor en Ciencias Médicas, PhD Desarrollo Humano. 3. Odontólogo ejercicio privado, egresada de la Universidad de Los Andes 4. Profesor en Universidad Santa María. Facultad de Odontología. Cátedra de Catedra de Cirugía Bucal y Anatomía. Caracas-Venezuela. Doctorando en Universidad de Sevilla, España. 5. Médico veterinario del Bioterio de la Universidad de Los Andes. Mérida-Venezuela. Autor Corresponsal: Dubraska Suárez. Facultad de Odontología. Edificio del Rectorado. Calle 23, entre Avenidas 2 y 3, Centro de Investigaciones Odontológicas, Universidad de Los Andes, Mérida (5101), Venezuela. Tel/Fax. 00(58) 274-2402378. E-mail: dubraskasuarez.ula@gmail.com. ORCID ID: https://orcid.org/0000-0003-1648-417X RESUMEN
En la odontología, se encuentran frecuentemente defectos óseos que ocasionan problemas funcionales y estéticos necesitando de un tratamiento complejo como la regeneración ósea guiada (ROG), la cual es una de las terapias con gran auge y éxito, pues contribuye a solventar alteraciones óseas por medio de biomateriales capaces de sustituir hueso perdido. La hormona de crecimiento (GH) y la fibrina inyectable (i-PRF), podrían ser opciones para estos fines, pero el efecto de un andamio de fibrina cargado con hormona de crecimiento aún no ha sido valorada. Objetivo: Evaluar el efecto de la i-PRF cargada con GH en la ROG. Metodología: 23 ratas BIOU: Wistar del Bioterio ULA, divididas en grupo experimental (21 ratas que recibieron GH e i-PRF en la tibia) un grupo control (21 ratas, solo i-PRF en la tibia) y un grupo control-control (2 ratas sin intervención). Las eutanasias fueron realizadas a las 3, 6 y 9 semanas para su posterior análisis radiográfico. Resultados: Las pruebas T empleadas para hallazgos radiográficos no arrojaron diferencias significativas en cuanto a la recuperación radiográfica pero si evidencian oseintegración mayor en iPRF-GH. Conclusión: La GH y la i-PRF pueden ser útiles en la regeneración ósea. Se recomienda evaluar histológicamente para mayor precisión de la efectividad del andamio iPRF-GH.
Palabras Clave: Hormona de crecimiento, i-PRF, regeneración ósea, biomaterial, Wistar.
INTRODUCCIÓN
En la búsqueda de nuevos materiales bioactivos para la ROG de defectos óseos en Odontología, la hormona de crecimiento (GH) se perfila como una posible alternativa; esta hormona es un proteína endógena, conocida como parte de los factores de crecimiento que ejerce acción reguladora impredecible del crecimiento óseo post-natal1-3, remodelado óseo4, 5, y promueve la diferenciación y proliferación de células madre6.
Dicha hormona se transporta en el torrente sanguíneo, una vez libre se une a receptores específicos de las células de múltiples tejidos y estimula la síntesis de otras sustancias denominadas factores de crecimiento7, dichos factores regulan su secreción e inhibición, como lo son: IGF-I (factores de crecimiento similares a la insulina), y esteroides sexuales8, los cuales desempeñan un papel importante en el crecimiento y desarrollo del hueso9-13
Estudios demuestran que la GH puede tener un efecto local, cuando es aplicada directamente sobre la zona a tratar debido a que permite la sustitución de biomaterial por hueso a través de la aceleración de la remodelación ósea. Sin embargo, dicha GH requiere de un material para su protección y contención física dentro del defecto óseo14.
En este sentido, los andamios ofrecen un nicho protector que permite la liberación de sustancias contenidas en su interior. Al respecto, un biomaterial autólogo que ha sido empleado con éxito en terapias regenerativas y que se perfila como una excelente andamio para ROG es la fibrina inyectable (i-PRF) la cual sirve como excelente vehículo para introducir materiales o tratamientos para estimular la regeneración de tejidos y a su vez al polimerizar funciona como relleno ante defectos óseos15,16.
La GH ha demostrado que su aplicación combinada con otros biomateriales en defectos óseos usado en ratas, generan la formación de tejido óseo y el proceso de cicatrización ósea4,17-23.Aunque la GH y el i-PRF se han investigado por separado, como tratamientos para la ROG, no se han encontrado estudios previos que planteen su empleo combinado en cirugía bucal. Por lo que se planteó como objetivo evaluar el efecto de la i-PRF cargada con GH como andamio bioactivo para la regeneración ósea.
MATERIALES Y MÉTODOS Esta investigación de tipo confirmatoria24 buscó verificar la hipótesis de que la aplicación de la fibrina inyectable con hormona de crecimiento resulta más efectiva en la regeneración de defectos óseos en ratas Wistar que su aplicación sin carga de hormona. Para ello se condujo un diseño de laboratorio24 recogiéndose los datos en el ambiente controlado del bioterio; tratándose también de un diseño experimental24, que comparó los hallazgos radiográficos del grupo control en contraste con los del grupo experimental tratado con el andamio bioactivo iPRF-GH. Sistema de variables
Variables independientes: andamio iPRF-GH y el iPRF control.
Variable dependiente: Regeneración ósea guiada.
Ejemplares biológicos
Los ejemplares biológicos estuvieron constituidos por 23 ratas de la cepa BIOU: Wistar con un peso comprendido entre 400 y 420 gr cada uno, aportados por el Bioterio de la Universidad de Los Andes (BIOULA).
Tomando en cuenta los criterios éticos establecidos por el bioterio, se debe emplear el menor número posible de animales; por lo cual, la cantidad usada en la investigación representa la mínima necesaria para el análisis estadístico. Técnica e instrumentos de recolección de datos
La técnica de recolección de datos fue la observación asistida técnicamente ya que se usó el negatoscopio para la evaluación de las radiografías. Se recolectaron los datos en una ficha de evaluación radiográfica bajo el siguiente modelo: 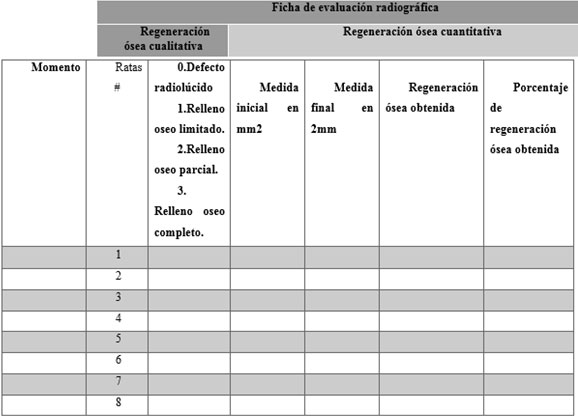 Figura 1. Formato de recolección de datos Figura 1. Formato de recolección de datos Evaluación radiográfica cualitativa Para la observación radiográfica cualitativa, se realizó una lista de cotejo que consta de 04 niveles la cual se aplicó a cada muestra25, y estos son: • Nivel 0: Defecto radiolúcido: sin variación radiográfica del defecto.
• Nivel 1: Relleno óseo limitado: el defecto óseo se mostró con imágenes radiopacas en los márgenes del defecto.
• Nivel 2: Relleno óseo parcial: el defecto óseo fue parcialmente radiopaco, con regiones de radiolucidez y radiopacidad, que indicaron la formación de hueso nuevo desde los márgenes del defecto sin establecer una continuidad.
• Nivel 3: Relleno óseo completo: el defecto óseo fue radiopaco en su totalidad.
Evaluación radiográfica cuantitativa En este parámetro radiográfico se tomó en cuenta el área de extensión de los defectos óseos al inicio y al final del experimento. Para ello se midió la longitud por el ancho del defecto óseo, se multiplicaron ambas mediciones para hallar el área expresada en milímetros cuadrados26. (Figura 2)
Área del defecto (Radiolucidez total) = Longitud x ancho Luego de obtener esta medida se procede a realizar la siguiente regla de tres para asi obtener el porcentaje de regeneración alcanzada para cada grupo de estudio. X= extensión de la radiopacidad * 100%
Área inicial del defecto K (1cm de longitud x 0,5 cm de ancho) 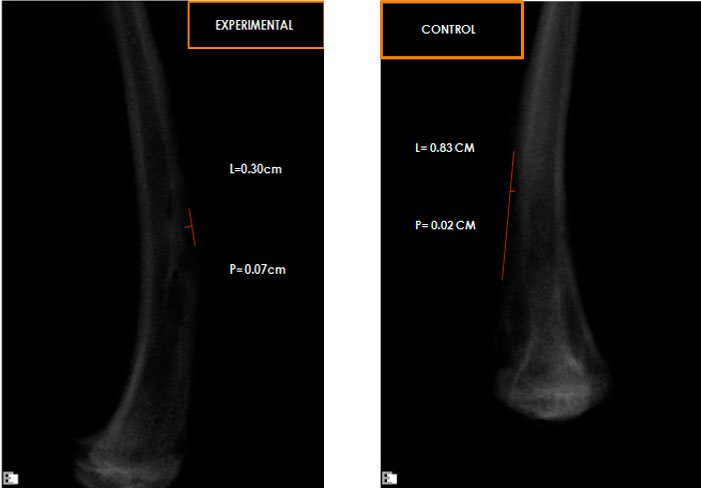 Figura 2. Radiografías de una muestra experimental y una muestra control, a las que se les realizó la medición de la radiolucidez presente, para así obtener el área expresada en milímetros cuadrados.
Procedimientos Fase I: Prueba piloto
Para asegurar la viabilidad y confiabilidad de la investigación, cumplir con las normas de bioética requeridas para el trabajo con animales de experimentación, además de comprobar la biocompatibilidad de los materiales empleados durante el procedimiento y realizar el defecto óseo en la tibia del animal; se realizó una prueba piloto en 2 ratas de la cepa Wistar con un peso aproximado de 400 gr; la cual se llevó a cabo dentro de las instalaciones del Bioterio de la Universidad de Los Andes (BIOULA) durante la semana previa al inicio de la investigación. Fase II: pre - operatoria.
Se usaron 23 ratas de la cepa Wistar, las cuales se dividieron en 3 grupos; uno experimental constituido por 21 ratas a las que se le aplicó en la tibia derecha hormona de crecimiento combinada con fibrina inyectable, un grupo control representado por las mismas 21 ratas del grupo anterior, pero a estas solo se les administró fibrina inyectable en la tibia izquierda, y por último un grupo control-control que estuvo compuesto por 2 ratas, las cuales no fueron sujetas a experimentación.
Luego de la seleccionar los grupos, organizar las mesas de trabajo con todos los insumos, instrumental y equipos necesarios, se asignaron de forma aleatoria los animales a cada grupo de evaluación 3, 6 y 9 semanas, identificándolos por marcas de color rodeando la base de la cola de los animales, de acuerdo al grupo de estudio. Obtención de la muestra sanguínea
La obtención de la muestra se realizó bajo anestesia, mediante la técnica de sangrado del seno venoso orbital, que implicó pinchar el seno venoso detrás del globo del ojo con un capilar; ya que es un método útil para obtener buenas muestras. Se usó una sola órbita recolectando entre 1,5 a 2 ml de sangre en tubos secos de tapa roja que no contenían anticoagulantes. (Fig. 3)  Figura 3. Recolección de muestra de sangre. Foto autoría propia Obtención de la fibrina inyectable:
• Una vez obtenida la muestra sanguínea, se llevó inmediatamente a la centrifuga por 2 minutos a 1.300 rpm a fuerza G de 1790 en una centrifuga mecánica, dicho protocolo se estandarizó en la prueba piloto previamente realizada, modificándose el protocolo descrito por Choukron para obtener dicha fibrina.
• Luego del tubo de ensayo previamente centrifugado se precedió a aspirar con una jeringa de insulina solo el PRF superior el cual está en estado líquido.
• Se activó la hormona de crecimiento mezclando el contenido de polvo liofilizado con un 1 ml de solución fisiológica.
• Se aspiró del envase 1 UI de hormona de crecimiento y luego se trasfirió ésta a la jeringa de la fibrina inyectable; buscando que las proporciones de ambos biomateriales fueran 1:1 y se homogenizaran, para su posterior aplicación en el sitio del defecto en el cual se requería el empleo de ambos biomateriales.
Fase III: quirúrgica.
• Se aplicó el anestésico general Ketamina en dosis de 100 mg/kg combinada con Xilacina 5 mg/kg, vía intraperitoneal, y también se administró en dosis de 0,25 ml la Lidocaína (Rapicaine®) al 2% con adrenalina al 1.100.000 (anestésico local), previa asepsia de la zona, se realizó una incisión con hoja de bisturí No 15 de 2 cm de longitud sobre la cara anterior de ambas patas traseras, luego se separó la piel y el espacio intramuscular hasta observar el musculo y el hueso. Y se procedió a realizar el defecto óseo con una turbina y fresa troncocónica 702 de aproximadamente 3 mm irrigando constantemente la zona con solución fisiológica.
• Luego se implantó el material de relleno que correspondía a cada grupo en el defecto creado y se suturó el musculo con sutura reabsorbible Vicryl® 4-0 y la piel con sutura no reabsorbible. (Figura 4) 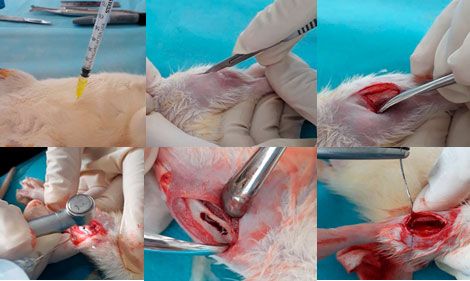 Figura 4. Procedimiento quirúrgico realizado en la tibia del animal de laboratorio. Fase IV: Post - quirúrgica.
• Inmediatamente terminada la cirugía se les administró analgésico- antiinflamatorio (Meloxicam 1 mg/kg) y antibiótico (Lincomicina, 0.015 ml) por vía subcutánea en dosis únicas. Esta medicación se continuó cada 24 horas por 3 días. Los animales se ubicaron en jaulas individuales, y fueron vigilados y alimentados por el personal técnico del BIOULA.
• A las 3, 6 y 9 semanas, se escogieron 7 ratas por grupo de experimentación para el sacrificio mediante la sobredosis inhalatoria de Euflurano USP al 100% mediante el uso de una cámara de gas, para luego obtener las muestras de tejido óseo que fueron inmersas en formol al 10% para los posteriores análisis radiográficos correspondientes. Una vez obtenidas las muestras se procedió a la disposición de los cadáveres, mediante su incineración en las instalaciones de BIOULA.
Principios bioéticos
Para conseguir el bienestar de los animales de laboratorio, se siguieron las normas vigentes. Dentro de los aspectos éticos se tomaron en cuenta:
• Utilizar la cantidad mínima necesaria de animales para obtener datos estadísticos válidos.
• Este proyecto fue presentado, discutido y aprobado por el Comité de Ética del Bioterio de la Universidad de Los Andes (CEBIOULA).
• La experimentación fue realizada en el área quirúrgica del bioterio de la universidad de los andes, bajo la supervisión de docentes y empleados con experiencia en el manejo de animales de laboratorio27.
• Los animales se mantuvieron en un ambiente apropiado con cierto grado de libertad de movimiento, alimento, agua y cuidados adecuados para asegurar su salud y bienestar.
• Los autores realizaron y aprobaron el curso de manipulación de animales de laboratorio en el Bioterio de la Universidad de Los Andes.
Análisis de resultados
Se elaboraron tablas cruzadas y gráficos de barra. Las medidas radiográficas se analizaron a través de la prueba T de Student para muestras independientes porque la distribución muestral no tiene una distribución normal. Para graficar datos se utilizó el programa Microsoft Office Excel 2013 y se usó el SPSS para las pruebas estadísticas.
RESULTADOS Hallazgos radiográficos cualitativos Radiopacidad del área intervenida y continuidad del defecto con el área circundante
Para estimar estos parámetros se siguió una lista de cotejo que muestra 4 niveles donde cada muestra se iba observando y se ubicaba en el nivel al cual correspondiera. Un nivel 0 donde se observaría un defecto totalmente radiolúcido sin variación radiográfica; un nivel 1 en el que se evidenciaría imágenes radiopacas en los márgenes del defecto mostrando así un relleno óseo limitado; un nivel 2 en el cual el defecto sería parcialmente radiopaco, con regiones de radiolucidez y radiopacidad que indicarían la formación de hueso nuevo; y por último, un nivel 3 donde se lograría un relleno óseo completo evidenciándose continuidad de los márgenes del defecto y éste se observaría radiopaco en su totalidad. La radiopacidad del área intervenida es valorada como la imagen radiográfica más densa o clara, debido a la gran densidad que posee el tejido que debería formarse dentro del defecto óseo; y también, fue valorada en función de la cantidad y extensión de la aposición mineral, lo que nos iría mostrando el nivel de neoformación ósea o nivel de mineralización del hueso. Seguidamente, teníamos el segundo parámetro continuidad del defecto con el área circundante que fue valorado si dicha aposición ósea mantuvo continuidad o no con las paredes en la periferia del defecto. En relación a lo anterior, se observó que el 43% de las muestras del grupo experimental llegaron a alcanzar un nivel 3 de regeneración ósea, es decir, se logró una regeneración completa, el restante de tibias alcanzó el nivel 2; por el contrario, para grupo control no se pudo evidenciar este hallazgo ya que ninguna de sus muestras alcanzaron este nivel, solo un 43% de sus muestras alcanzó un nivel 2 de relleno óseo parcial, y el restante de las tibias correspondientes a éste grupo se ubicaron en un nivel 1 y hasta en un nivel 0. (Gráfico 1). 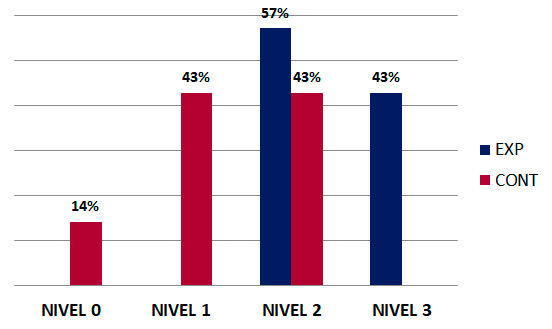 Gráfico 1. Nivel de regeneración ósea alcanzada a las 9 semanas post quirúrgicas para el grupo experimental y el grupo control. Gráfico 1. Nivel de regeneración ósea alcanzada a las 9 semanas post quirúrgicas para el grupo experimental y el grupo control. Hallazgos radiográficos cuantitativos Extensión de la radiopacidad
Para estimar este parámetro se tomó en cuenta el área de extensión de los defectos óseos al inicio y al final del experimento. Para ello se midió la longitud por el ancho del defecto óseo, se multiplicaron ambas mediciones para hallar el área expresada en milímetros cuadrados alcanzado a las 9 semanas. En el grupo experimental se observó que hubo menor área de extensión que en el grupo control como se puede apreciar en el grafico 6. De forma detallada para el grupo experimental el área alcanzada fue de 45mm², mientras que para el grupo control fue de 47mm² (Gráfico 2).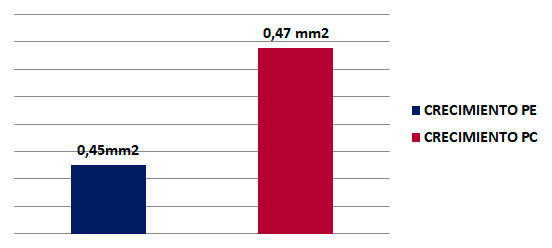 Gráfico 2. Área de extensión de radiopacidad alcanzada a las 9 semanas por ambos grupos de estudio.Porcentaje de regeneración ósea Adicionalmente partiendo de las medidas anteriores para cada tibia (área de extensión de radiopacidad), se obtuvo una medida porcentual de la neoformación ósea o porcentaje de regeneración ósea alcanzada en cantidad o cuantitativamente por la fórmula explicada en el anterior capítulo de marco metodológico. Partiendo de dicha fórmula se evidenció el porcentaje alcanzado de regeneración ósea final en función del área inicial. Con respecto a lo anterior, se pudo apreciar que a las 9 semanas la frecuencia para ambos grupos de estudio (experimental y control) era muy similar; el grupo experimental obtuvo un 90% de regeneración ósea, mientras que en el grupo control se evidencio una regeneración ósea un poco más marcada de un 94%. (Gráfico 3). 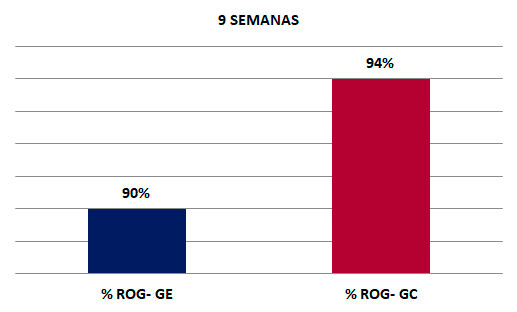 Gráfico 3. Porcentaje de regeneración ósea alcanzada a las 9 semanas para ambos grupos de estudio. 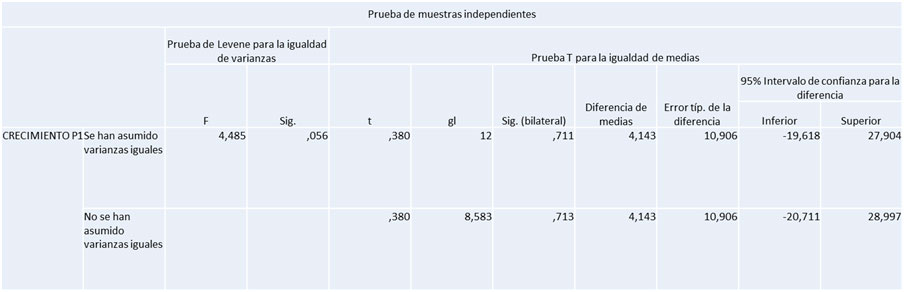 Tabla 1. Prueba T. significancia estadística radiográfica de la 9 semana del grupo experimental 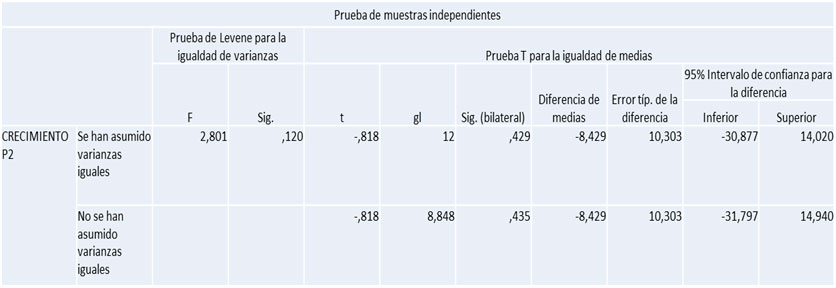 Tabla 2. Prueba T. significancia estadística radiográfica de la 9 semana del grupo e control.  Ninguna prueba T resultó significativa (Significancia mayor a 0,05). Esto quiere decir que en el momento evaluado no se encontraron diferencias significativas en la evaluación radiográfica. DISCUSIÓN En los últimos años diversos grupos de estudios dedicados a la investigación en cirugía y traumatología bucomaxilofacial y en implantología oral han utilizado numerosos compuestos para mejorar la respuesta ósea. Entre los más importantes se encuentran los factores de crecimiento como el i-PRF y más recientemente las hormonas, como por ejemplo, la hormona de crecimiento. En esta oportunidad se estudió la efectividad de la hormona de crecimiento combinada con la fibrina inyectable en defectos realizados en la tibia de ratas para regeneración ósea, y evaluar posteriormente su posible aplicabilidad clínica. Para la realización del análisis radiográfico cualitativo, se tomaron en cuenta dos parámetros; radiopacidad y radiolucidez. En relación a esto, se evidenció que el 43% de las muestras del grupo experimental alcanzó el relleno óseo completo; similar al estudio de Ortega y Paredes28, donde a los 60 días de la implantación del PRF el 40% de las muestras obtuvieron un nivel de regeneración grado 3. Los grupos estudiados con ambos materiales demostraron proliferación de tejido óseo evidente radiográficamente, logrando acelerar el proceso de regeneración ósea, lográndose un hueso similar al sano, es decir, se generó un hueso de calidad. Estos resultados pueden atribuirse a la capacidad que tienen los materiales utilizados para unirse a los osteoblastos y promover la maduración ósea. Además, se realizó un análisis radiográfico cuantitativo donde se observó la cantidad (extensión o área) de hueso neoformado dentro de los defectos realizados. Al respecto, los resultados radiográficos obtenidos señalaron una tendencia en las tibias tratadas con i-PRF (grupo control) con un predominio de en un 94% de ganancia ósea, obteniendo así un alto porcentaje de regeneración.
Comparado con un estudio clínico en el área de periodoncia donde al control radiográfico se observó la formación total del hueso en el área del defecto y también en un estudio clínico en Endodoncia que al control radiográfico hubo formación de matriz ósea en el defecto óseo; por lo tanto el PRF puede ser usado para regenerar pequeños y grandes defectos óseos ya que se obtiene una respuesta esperada y asociada a la posibilidad del biomaterial para actuar como osteoconductor, al brindar soporte, contacto y adhesión celular; este comportamiento ha sido confirmado por varios estudios29-31, donde se evidencio que el i-PRF actúa como andamio liberando lentamente factores de crecimiento, además favorece al aumento en número de leucocitos y puede estimular aún más factores. En comparación, el grupo experimental mostró una pequeña diferencia con el grupo control, ya que obtuvo menos porcentaje de regeneración ósea (90%) esto pudo deberse a la superposición de estructuras óseas de la tibia de las ratas en las imágenes o el ángulo de toma de radiografías, quedando a criterio de próximos investigadores la posibilidad de realizar este tipo de investigaciones con pruebas más avanzadas como estudios tomográficos. Aún y cuando sucedió este fenómeno, hubo una buena osteoinducción por parte de estos dos biomateriales, ya que estimularon el crecimiento de hueso en el sitio donde se implantó, comportándose la GH como excelente regenerador óseo, ya que media la interacción osteoblasto-osteoclasto e interviene de forma activa en el remodelado óseo tal como lo expresa Arrienti32 en su estudio; y el i-PRF como andamio bioactivo para mantener la GH en el sitio a tratar, además de potenciar el relleno del defecto. CONCLUSIONES • Las pruebas estadísticas a nivel radiográfico no arrojaron diferencias significativas, pero esto puede deberse al número reducido de las muestras.
• En la totalidad de los casos experimentales, se evidenció la osteointegración positiva del biomaterial, lo que denotó su biocompatibilidad, bioactividad y bioestabilidad.
• Se recomienda ejecutar el mismo estudio por un período de evaluación mayor, realizando análisis histológico para determinar cambios más precisos detectándose el tiempo que tarda en producirse la regeneración total de los defectos óseos tratados.
• Es recomendable también aumentar el tamaño de muestra de los especímenes para hacer más evidentes las diferencias estadísticas entre los grupos experimentales y el grupo control. REFERENCIAS BIBLIOGRÁFICAS 1. Sjögren K, Liu JL, Blad K, Skrtic S, Vidal O, Wallenius V, et al. Liver-derived insulin-like growth factor I (IGF-I) is the principal source of IGF-I in blood but is not required for postnatal body growth in mice. Proc Natl Acad Sci U S A. 1999; 96(12):7088-92.
2. Baker AR, Hollingshead PG, Pitts-Meek S, Hansen S, Taylor R, Stewart TA. Osteoblast-specific expression of growth hormone stimulates bone growth in transgenic mice. Mol Cell Biol [Internet]. 1992; 12(12):5541-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC360492/pdf/molcellb00135-0271.pdf
3. Morales O, Lindgren U, Haldose L. Growth Hormone - Regulated Intracellular Signaling in UMR 106 Osteosarcoma Cells. J bone Miner Res [Internet]. 2000; 15(11):2284-90. Disponible en: http://onlinelibrary.wiley.com/doi/10.1359/jbmr.2000.15.11.2284/pdf
4. Arrienti R. Acción local de la hormona de crecimiento en polvo liofilizado asociada a injertos óseos en cirugia implantológica. Estudio Experimental. [Internet]. Universidad Nacional de La Plata; 2016. Disponible en: http://sedici.unlp.edu.ar/bitstream/handle/10915/57405/Documento_completo.pdf-PDFA.pdf?sequence=3
5. Salgado J, Bolognesi J, Henriques L, Naval M, Trindade A, Souza E. Effect of growth hormone in experimental tooth movement. Braz Dent J [Internet]. 2013; 24(5):503-7. Disponible en: http://www.scielo.br/pdf/bdj/v24n5/0103-6440-bdj-24-05-503.pdf
6. Ong CK, Joseph BK, Waters MJ, Symons AL. Growth hormone receptor and IGF-I receptor immunoreactivity during orthodontic tooth movement in the prednisolone-treated rat. Angle Orthod [Internet]. 2001; 71(6):486-93. Disponible en: http://www.angle.org/doi/pdf/10.1043/0003-3219%282001%29071%3C0486%3AGHRAII%3E2.0.CO%3B2?code=angf-site
7. Ceglia A. Indicadores de maduración de la edad ósea, dental y morfológica. Rev Latinoam Ortod y Odontopediatría [Internet]. 2005; 1-11. Disponible en: https://www.ortodoncia.ws/publicaciones/2005/art-12/
8. Requia M, Valiati R, Hubler R, Nunes A, Antonini F, Oliveira H, et al. Effect of recombinant human Growth Hormone (rhGH) on osseointegration of titanium implants : a histological and biomechanical study in rabbits. J Oral Implantol. 2014; 41(4).
9. Locatelli V, Bianchi VE. Effect of GH/IGF-1 on Bone Metabolism and Osteoporsosis. Int J Endocrinol. 2014; 1-25.
10. Sanchez J, Navarro D, Hernández A. Acción fisiopatológica integrada de las hormonas sobre el tejido óseo. Rev Cuba Endocrinol [Internet]. 2006; 17(2). Disponible en: http://www.bvs.sld.cu/revistas/end/vol17_2_06/end05206.htm
11. Carrascosa A. Masa ósea. Factores reguladores. Rev Española Pediatr [Internet]. 2003; 59(1):15-28. Disponible en: http://www.seinap.es/wp-content/uploads/Revista-de-Pediatria/2003/REP 59-1.pdf
12. Reyes R, Rozas P, Muñoz M. Regulación del proceso de remodelado óseo. Rev Esp Enfermedades Metab Oseas [Internet]. 2008; 17(1):10-4. Disponible en: http://www.elsevier.es/es-revista-reemo-70-articulo-regulacin-del-proceso-de-remodelado-13114862
13. Nicholls AR, Holt RIG. Growth Hormone and Insulin-Like Growth Factor-1. Front Horm Res. 2016; 47:101-14.
14. Lucheti C. «Estudio comparativo de injertos de hueso en regeneración ósea guiada. Caracterización de la respuesta frente a injertos autólogos y sustitutos de origen humano, bovino y químico» [Internet]. Universidad Nacional de la Plata; 2004. Disponible en: http://sedici.unlp.edu.ar/bitstream/handle/10915/2110/Documento_completo.pdf?sequence=1
15. Lorenz J, Al-Maawi S, Sader R, Ghanaati S. Individualized titanium mesh combined with platelet-rich fibrin and deproteinized bovine bone: A new approach for challenging augmentation. J Oral Implantol. 2018; 44(5):345-51.
16. Chenchev I, Ivanova V, Neychev D, Cholakova R. Application of Platelet-Rich Fibrin and Injectable Platelet-Rich Fibrin in Combination of Bone Substitute Material for Alveolar Ridge Augmentation - a Case Report. 59(3):362-6.
17. Andreassen TT, Oxlund H. Local anabolic effects of growth hormone on intact bone and healing fractures in rats. Calcif Tissue Int. 2003; 73(3):258-64.
18. Hedner EWA, Linde A, Nilsson A. Systemically and Locally Administered Growth Hormone Stimulates Bone Healing in Combination with Osteopromotive Membranes : An experimental Study in Rats. J Bone Miner Res. 1996; 11(12):1952-60.
19. Nielsen HM, Bak B, Jørgensen PH, Andreassen TT. Growth hormone promotes healing of tibial fractures in the rat. Acta Orthop Scand. 1991; 62(3):244-7.
20. Andreassen T, Jorgensen P, Flyvbjerg A, Orskov H, Oxlund H. Growth Hormone Stimulates Bone Formation and Strength of Cortical Bone in Aged Rats. J bone Miner Res. 1995;10(7):1057-67.
21. Bak B, Andreassen TT. The effect of growth hormone on fracture healing in old rats. Bone. 1991;12(3):151-4.
22. Kidder L, Schmidt I, Evans G, Turner R. Effects of growth hormone and low dose estrogen on bone growth and turnover in long bones of hypophysectomized rats. Calcif Tissue Int. 1997; 61(4):327-35.
23. Duarte A. Efecto de la hormona de crecimiento en el hueso viejo: análisis morfométrico y densitométrico en ratas Wistar [Internet]. universidad complutense de madrid; 2014. Disponible en: http://eprints.ucm.es/28537/1/Trabajo Fin Master.pdf
24. Hurtado J. El proyecto de investigación. Metodología de la Investigación Holistica. 4ta edició. 2006.
25. Molina F. Efecto del plasma rico en factores de crecimiento (PRFC) en la regeneración de tejidos blandos y tejido óseo. Estudio experimental en conejos albinos de Nueva Zelanda. Universidad de Murcia; 2008.
26. Suarez D. Eficiencia del liposoma a base de quitosano para la regeneración ósea guiada en ratas wistar. Universidad de Los Andes; 2012.
27. Cuesta L, Sanchez K. Aspectos éticos de la experimentación con animales. cbioetica [Internet]. 2007; Disponible en: http://cbioetica.org/revista/72/722527.pdf
28. Ortega O, Paredes A. Análisis comparativo de la regeneración ósea obtenida con quitosano y plasma rico en fibrina. Universidad de Los Andes; 2012.
29. Wang X, Zhang Y, Choukroun J, Ghanaati S, Miron RJ. Effects of an injectable platelet-rich fibrin on osteoblast behavior and bone tissue formation in comparison to platelet-rich plasma bone tissue formation in comparison to platelet-rich plasma. Platelets [Internet]. 2017; 0(0):1-8. Disponible en: http://dx.doi.org/10.1080/09537104.2017.1293807
30. Ghanaati S, Booms P, Orlowska A, Kubesch A, Lorenz J, Rutkowski J, et al. Advance platelet-rich fibrin: a new concept for cell-based tissue engineering by means of inflammatory cells. J Oral Implant. 2014; 40(6):689-89.
31. Fujioka M, Miron R, Hernandez M, Kandalam U, Zhang Y. Optimized platelet-Rich Fibrin With the Low-Speed Concept: Growt Factor Release, Biocompatibility, and Cellular Response. J Periodontol. 2017; 88(1):112-21.
32. Arrienti R. Acción local de la hormona de crecimiento en polvo liofilizado asociada a injertos óseos en cirugia implantológica. Estudio Experimental. [Internet]. Universidad Nacional de La Plata; 2016. Disponible en: http://sedici.unlp.edu.ar/bitstream/handle/10915/57405/Documento_completo.pdf-PDFA.pdf?sequence=3
|
 Figura 1. Formato de recolección de datos
Figura 1. Formato de recolección de datos


 Gráfico 1. Nivel de regeneración ósea alcanzada a las 9 semanas post quirúrgicas para el grupo experimental y el grupo control.
Gráfico 1. Nivel de regeneración ósea alcanzada a las 9 semanas post quirúrgicas para el grupo experimental y el grupo control.


