Dubraska V. Suárez-Vega1, Gladys J. Velazco de Maldonado 2, Frambelys A. Viloria-Rivas3, Vanessa C. Guerrero-Méndez3, Eduvigis A. Solorzano4, Yepsis Montero5.
1. Profesor en Universidad de Los Andes. Facultad de Odontología. Departamento de Investigación. Centro de Investigaciones Odontológicas. Mérida-Venezuela.
2. Profesor en Universidad de Los Andes. Facultad de Odontología. Centro de Investigaciones Odontológicas. Mérida-Venezuela.
3. Odontólogo ejercicio privado, egresada de la Universidad de Los Andes
4. Profesor en Universidad de Los Andes. Facultad de Odontología. Departamento de Medicina Oral. Cátedra de Histología. Laboratorio Integrado de Biología Celular y Molecular. Mérida-Venezuela.
5. Médico veterinario del Bioterio de la Universidad de Los Andes. Mérida-Venezuela.
Autor Corresponsal: Dubraska Suárez. Facultad de Odontología. Edificio del Rectorado. Calle 23, entre Avenidas 2 y 3, Departamento de Investigación, Universidad de Los Andes, Mérida (5101), Venezuela. Tel/Fax. 00(58) 274-2402379. E-mail: dubraskasuarez.ula@gmail.com. ORCID ID: https://orcid.org/0000-0003-1648-417XRESUMEN
Introducción: En endodoncia regenerativa los procedimientos están destinados a reemplazar células del complejo dentino-pulpar, la dentina y estructuras radiculares dañadas o perdidas, mediante tratamientos alternativos como andamiaje tisular para la bioestimulación tisular. La fibrina rica en plaquetas inyectable (iPRF) puede cumplir un papel prometedor por la liberación de factores de crecimiento implicados en la regeneración de los tejidos, sin embargo no existe evidencia acerca de su efecto en pulpitis dental. Objetivo: Evaluar la bioestimulación del complejo dentinopulpar con iPRF en ratas BIOU:Wistar. Materiales y Métodos: Se realizó un estudio experimental preclínico en 20 ratas BIOU:Wistar. Los animales se dividieron 3 en grupos conformados por 9 ratas BIOU:Wistar para el grupo control, 9 para el grupo experimental y 2 para el grupo control- control. En ambos grupos se indujo pulpitis, solo el grupo experimental recibió iPRF. Los dientes de ambos grupos se sellaron con Mineral Trioxido Agregado (MTA) y restauración de ionómero de vidrio fotopolimerizable. Se valoró histomorfometría a los 15 y 30 días. Resultados: El grupo experimental mostró ausencia de infiltrado inflamatorio y necrosis pulpar en 100% de los dientes que inicialmente tenían pulpitis; sin embargo en el grupo control el 50% mostró infiltrado inflamatorio y el 80% presentó fibrosis pulpar. En ambos grupos hubo formación de vasos sanguíneos (20%), y presencia de la capa odontoblástica (100%). Conclusión: iPRF es potencialmente un andamio ideal para revertir pulpitis, aumentando la capacidad de reparación del complejo dentinopulpar.
Palabras clave: pulpitis, bioestimulación, endodoncia regenerativa, fibrina rica en plaquetas, mineral trióxido agregado. INTRODUCCION
En los últimos años en Estomatología se ha desarrollado un nuevo campo de conocimiento altamente interesante conocido con el nombre de ingeniería tisular, que propone nuevas terapias que implican la regeneración o reparación de tejidos dañados, así como también la creación de órganos de reemplazo. Este campo se ha construido sobre la investigación de materiales biocompatibles, soportes naturales y sintéticos, células y señalizadores específicos para crear un nuevo tejido 1- 8.
En lo que se refiere a la regeneración de tejidos como pulpa, hueso y mucosa bucal, se han realizado avances importantes que dan lugar a un nuevo campo en la odontología: La "Odontología Regenerativa" 2, 6. Estos principios aplicados al campo de la endodoncia regenerativa han dado lugar a procedimientos biológicamente diseñados para remplazar estructuras dañadas, incluyendo dentina y estructura radicular, como también células del complejo dentino-pulpar 2, 4, 7, 8; en consecuencia es posible la regeneración endodóntica o revascularización pulpar a través de la creación y formación de tejidos para reemplazar pulpa infectada, necrótica o traumatizada 2.
El desarrollo de estas terapias regenerativas resulta conveniente pues las patologías pulpares y periapicales son las enfermedades que más llevan a los pacientes a acudir a la consulta odontológica debido a su sintomatología 9, 10. En este particular, se puede señalar a la Terapia Pulpar Vital (TPV) como una opción que ha sido sugerida como una alternativa de tratamiento en exposiciones pulpares, ya que procura preservar y/o favorecer la permanencia de los dientes en boca manteniendo la vitalidad pulpar luego de la exposición traumática, accidental o incluso por procesos cariosos 4, 5. La pulpotomía es considerada una TPV en la cual se remueve la pulpa coronal o cameral, y el remanente del tejido radicular es recubierto con un material adecuado que protege la pulpa y permite promover la cicatrización como el mineral Trióxido agregado (MTA) y un concentrado plaquetario notablemente conocido, el plasma rico en plaquetas (PRP); ambos son considerados como coadyuvantes exitosos en la TPV 1.
Los concentrados de plaquetas surgieron como respuesta a la necesidad de utilizar un material biológico que permitiera la rápida activación, migración, proliferación y diferenciación celular 1, en cuanto a ello la fibrina rica en plaquetas inyectable, contiene altas cantidades de factores de crecimiento 11 y su aplicación se ha extendido a varios campos diferentes, incluyendo la odontología (cirugía plástica periodontal y maxilofacial), medicina, cosmética, estética 12.
Esto sin duda ha dado un impulso hacia la aplicación de moléculas bioactivas en la endodoncia regenerativa. Sin embargo, varias preguntas siguen sin estar claras en cuanto a la utilización de moléculas morfogénicas en la ingeniería de los tejidos de la pulpa dental 11.
Estudios en Chile y Colombia destacan el uso de concentrados autólogos plaquetarios como posibilidad terapéutica para la revascularización pulpar. Por su parte en Estados Unidos, Cuba y Venezuela los estudios sobre los concentrados plaquetarios para regeneración pulpar no son específicos, a su vez pertenecen a la categoría de artículos de revisión sistemática y no a estudios experimentales 1, 4, 9,14.
Es por tanto que esta investigación pretendió responder la siguiente pregunta: ¿La fibrina rica en plaquetas prepolimerizable o inyectable provoca la regeneración del complejo dentino-pulpar? Para ello se propuso como objetivo: Evaluar histológicamente la reparación y/o regeneración del complejo dentinopulpar a los 15 días y al mes posterior a la terapia de bioestimulación.
Para ello se desarrolló una investigación que respondiera a esta pregunta, justificada en la necesidad de un ensayo preclínico en animales de experimentación pues en la literatura consultada correspondiente a los últimos diez años, no se encontraron estudios clínicos controlados en los cuales se evaluará el efecto del iPRF para la regeneración y/o revascularización pulpar.
Además se consideró relevante ya que de comprobarse la eficacia del PRP en la regeneración pulpar en las ratas BIOU:Wistar, se presentará a la comunidad científica odontológica como una opción terapéutica con la finalidad de preservar la vitalidad de la pulpa, evitando recurrir como primera opción al tratamiento convencional de conductos, teniendo como objetivo conservar o regenerar el complejo dentinopulpar; para que en un futuro a corto plazo la técnica de colocación de iPRF como tratamiento alternativo en la regeneración pulpar, sea un tratamiento de elección para los pacientes que requieran de alguna terapia endodóntica. Por otro lado, sería un tratamiento de mayor accesibilidad, debido a su bajo costo y por su fácil obtención ya que el PRP se adquiere de los propios elementos sanguíneos del paciente.
MATERIALES Y MÉTODOS
La presente investigación cuantitativa15, confirmatoria y de diseño experimental16, se trató específicamente un ensayo preclínico que determinó la respuesta del complejo dentinopulpar (variable dependiente) tratado con iPRF (variable independiente) en contraste con un grupo control.
Se determinaron distintos parámetros:
a) Hallazgos Clínicos: Se evaluó el estado general del animal en estudio a las 72 horas de realizar la inducción de la pulpitis, en base a los indicadores de dolor como Pérdida de peso, Deshidratación, Diarrea, Estreñimiento, Agresividad, Lordosis, Piloerección. Dichos indicadores tuvieron una escala de estimación que permitió registrar estructuradamente la presencia o ausencia de los distintos parámetros clínicos (1: presencia 2: ausencia 3: dudoso). b) Hallazgos Histológicos: Fueron evaluados a través de los siguientes indicadores, según los criterios de Cortés et al. 200117 y otros autores18-22:
Tabla 1. Parámetros histológicos evaluados. Grado de inflamación: Necrosis pulpar: Fibrosis: Capa odontoblástica: Formación de vasos sanguíneos:
0: Ninguna, pulpa vital sin inflamación.
1: Leve, pocas células inflamatorias.
2: Moderada, inflamación y trastornos circulatorios que afectan a la totalidad de la pulpa.
3: Severa, inflamación y trastornos circulatorios que afectan a la totalidad de la pulpa, también se incluyen los dientes con necrosis parcial. 0: Ausencia de necrosis.
1: Necrosis total.
0: Ausencia de fibrosis.
1: Presencia de fibrosis en la pulpa.
0: Ausencia de capa regular de odontoblastos.
1: Presencia de capa regular de odontoblastos.
0: Ausencia vasos sanguíneos nuevos.
1: Presencia vasos sanguíneos nuevos.
La recolección de datos se llevó a cabo mediante la técnica de observación directa (16) para el registro de hallazgos clínicos e indirecta (16) para los datos histológicos. Los datos se vaciaron en fichas de registro que contenían la escala de estimación de los diferentes indicadores.
El instrumento fue validado mediante juicio de expertos en el área; los parámetros clínicos de dolor de los animales fueron validados por un médico veterinario, experto en el manejo de animales de laboratorio del BIOULA y la evaluación histológica un odontólogo, experto en Histopatología bucal, quienes revisaron y emitieron opiniones sobre la coherencia y pertinencia de los aspectos a estudiar en el instrumento.
La muestra estuvo formada por 22 ratas BIOU: Wistar (rattus norveguicus albinus) adultas macho sanas y no consanguíneas con un peso comprendido entre 380-420gr provenientes del Bioterio de la Universidad de Los Andes, Mérida- Venezuela (BIOULA), las cuales se dividieron de la siguiente manera: 2 ratas BIOU:Wistar fueron para la prueba piloto, 2 formaron parte del control- control, 9 para el grupo control, 9 ratas BIOU:Wistar para el grupo experimental al que se aplicó el biomaterial (iPRF), se asignaron al azar para pertenecer a cada grupo.
Se valoraron clínica e histológicamente a los 15 y 30 días de inducida la pulpitis. Los datos fueron analizados con procedimientos de estadística descriptiva en el SPSS® versión 15.0.
Aspectos bioéticos sobre la experimentación en animales
Se respetaron las directrices de la guía ARRIVE, establecidas para el reporte de estudios en animales de experimentación. Además se empleó la cantidad mínima necesaria de animales para el estudio, correspondiente a la regla de las 3Rs (reemplazo, reducción y refinamiento) planteado por Russell y Burch y exigidas por el Bioterio de la ULA.
Los autores realizaron un adiestramiento, para la manipulación y experimentación de animales vivos, que fue recibido en el BIOULA y dictado por especialistas en el manejo de animales de laboratorio.
Se realizó una prueba piloto con dos ratas BIOU:Wistar, con la finalidad de estandarizar el procedimiento de inducción de la patología pulpar (pulpitis).Todos los procedimientos fueron supervisados por el personal capacitado de las instalaciones del BIOULA.
Esta investigación, fue aprobada por la comisión de Bioética del Bioterio de la Universidad de los Andes bajo el código CEBIOULA/099, adicionalmente fue arbitrado ante el CDCHTA (Consejo de Desarrollo Científico, Humanístico, Tecnológico y de las Artes) ULA.
Procedimientos
Prueba piloto
Para asegurar la viabilidad y confiablidad de esta investigación y cumplir con las normas bioéticas requeridas para el trabajo con animales de laboratorio se realizó una prueba piloto con una muestra de 2 ratas machos sanas de la línea BIOU:Wistar adultas, con un peso comprendido entre 450-500 grs del BIOULA.
El propósito de la prueba piloto además de realizar la selección del modelo animal a utilizar, fue adquirir las destrezas para la correcta manipulación de los animales, precisión de la dosis anestésica a usar en el experimento, conocer la configuración anatómica y dimensiones de la pieza dental a trabajar y de esta manera estandarizar el procedimiento de la apertura de la cavidad en uno de los dientes con el objetivo de inducir una pulpitis.
Como resultado se logró instaurar pulpitis en un lapso de 72 horas verificado clínicamente por la inspección clínica dental y verificación de parámetros de la respuesta dolorosa y comportamiento aprehensivo e inapetente de los animales.
Experimentación
Una vez identificados cada uno de los integrantes de cada grupo (figura 1) se separaron en jaulas identificadas procediendo a realizar la inducción de la pulpitis en los grupos control y experimental. 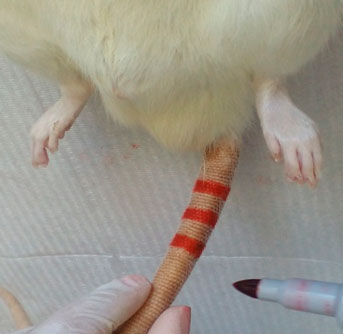 Figura 1. Identificación de los ejemplares por medio de aros de colores en la cola, azul control, rojo experimental, negro control-control. El procedimiento consistió en administrar al animal anestesia general (ketamina 100mg/kg y Xilacina 10mg/kg) 0,5ml por vía intraperitoneal, posteriormente a cada animal por intervenir perteneciente al grupo experimental se le extrajo 2ml de sangre por vía retro orbital mediante el uso de capilares en tubos sin anticoagulante (figura 2), una vez obtenida la muestra se centrifugó por 2 minutos a una velocidad de 1000 rpm para la obtención del iPRF, una vez obtenido se cargó en una jeringa de insulina para ser llevado a la cámara pulpar. 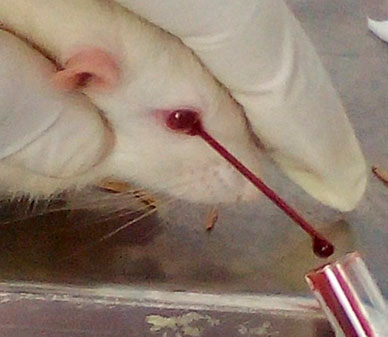 Figura 2. Extracción de sangre del ojo del animal mediante el uso de capilares sin anticoagulante
A los grupos experimental y control se les aplicó como anestésico local 0,25 ml de Lidocaína al 2%, bajo la técnica anestésica infiltrativa (figura 3), posteriormente se procedió al aislamiento relativo del campo operatorio con rollos de algodón y gasas. Mediante instrumental rotatorio (turbina), una fresa de carburo redonda # ½ y refrigeración constante con solución fisiológica a través de una jeringa se inició el abordaje hacia la cámara pulpar (figura 4); para la verificación del acceso a cámara pulpar se empleó una lima endodóntica #6 (figura 5), y así mismo se procedió a la inducción de la pulpitis a través de una herida pulpar, evitando la contaminación microbiana.
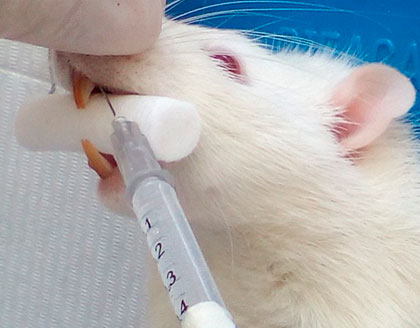
Figura 3. Aplicación del anestésico local 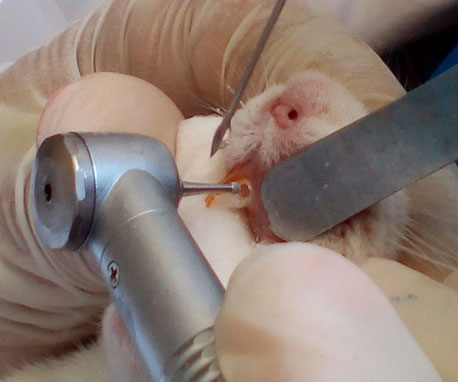
Figura 4. Abordaje dental en aislamiento relativo 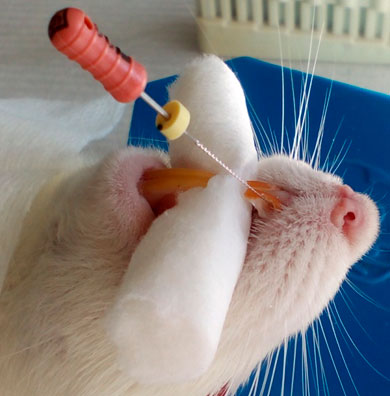
Figura 5. Verificación del acceso a cámara pulpar
Se irrigó con solución fisiológica y se secó con conos de papel (figura 6), al grupo experimental se le colocó iPRF empleando jeringa de insulina (figura 7), dicho biomaterial se protegió a través de un sellado coronal con MTA (figura 8) y una restauración con ionómero de vidrio fotopolimerizable (figura 9); el grupo control solo fue sellado la cámara pulpar con MTA y ionómero, mientras que el grupo control-control no recibió ninguna intervención.

Figura 6. Secado de la cavidad con conos de papel 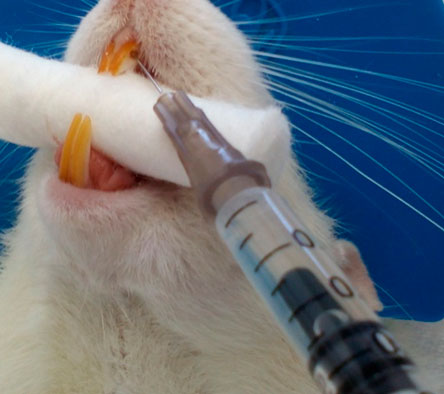 Figura 7. Aplicación del iPRF al grupo experimental 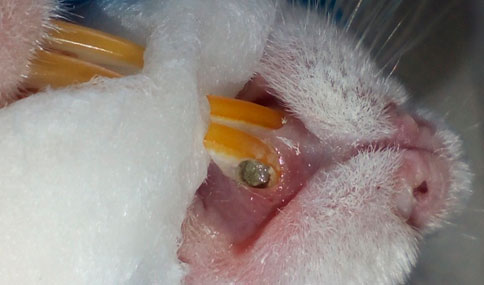
Figura 8. Aplicación del MTA   Figura 9. Restauración con ionómero de vidrio fotopolimerizable Eutanasia, recolección y procesamiento de datos
Se realizó la eutanasia mediante sobredosis de Euflurano USP inhalado, diseccionando el bloque del maxilar superior para mejor acceso a los cortes a nivel de la corona clínica (figura 10), fijándolos posteriormente en formalina al 10%. Las muestras dentales se descalcificaron con ácido nítrico al 2%, fueron fijadas en parafina, obteniéndose los cortes observados con un microscopio óptico de visión múltiple (LEICA DME) junto a un Médico Anatomopatólogo, Profesora de Anatomía Patológica en la Facultad de Odontología de la Universidad de los Andes. Para medir cada uno de los indicadores se utilizó la muestra del control-control para establecer la normalidad de los tejidos y compararlo con los grupos control y experimental. 
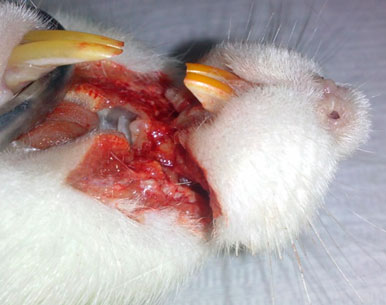
Figura 10. Disección del bloque del maxilar superior RESULTADOS
Para la evaluación de los hallazgos histológicos, se tomaron en cuenta los estudios de Cortés et al. 200117 y otros autores18-22; así como la opinión de expertos validadores del instrumento. En la evaluación histológica se obtuvieron los siguientes resultados: 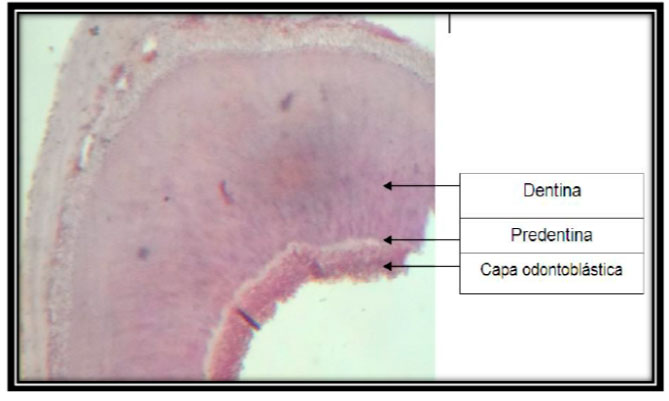
Figura 11: Preparado histológico. Corte longitudinal del incisivo central superior izquierdo; histológicamente se observa la presencia de las estructuras dentales. Aumento a 10x, hematoxilina-eosina.
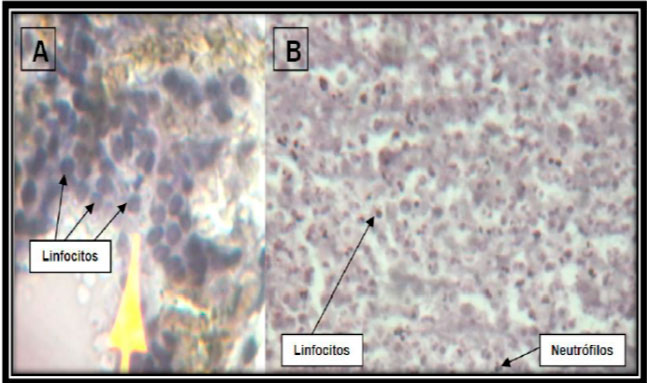
Figura 12: Preparado histológico. Corte longitudinal del incisivo central superior izquierdo, con implantación de MTA. Hay abundantes elementos celulares inflamatorios: (A) linfocitos, (B) neutrófilos y linfocitos. Aumento 40x, hematoxilina-eosina. 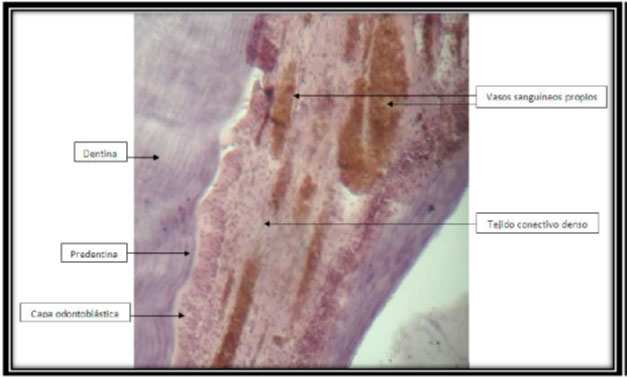 Figura 13: Preparado histológico. Corte longitudinal del incisivo central superior izquierdo con implantación de MTA; histológicamente se observa la presencia de la capa odontoblástica, tejido conectivo denso con presencia fibroblastos y vasos sanguíneos propios. Aumento a 10x, hematoxilina-eosina.  Figura 14: Preparado histológico. Corte longitudinal del incisivo central superior izquierdo, con implantación del material autólogo (PRP); histológicamente se observa la pulpa dental con un tejido conectivo denso, abundante fibras colágenas, hay la presencia de fibroblastos. Aumento 40x, hematoxilina-eosina. 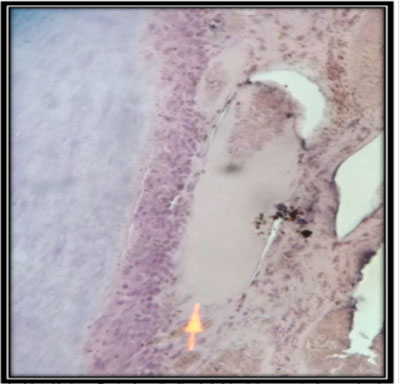 Figura 15: Preparado histológico. Corte longitudinal del incisivo central superior izquierdo, con implantación del material autólogo (PRP). Histológicamente se observa la presencia de canal con material rosado eosinófilico acelular, tejido conectivo denso y celular. Aumento a 10x, hematoxilina-eosina.
En la primera evaluación histológica a los 15 días en el grupo control se observó que el 25% de los animales presentó infiltrado inflamatorio leve, un 25% mostro infiltrado inflamatorio moderado y el 50% restante tuvo ausencia de infiltrado inflamatorio y necrosis pulpar. Sin embargo el 50% demostró que hubo presencia de fibrosis pulpar y formación de vasos sanguíneos, por otro lado en el 100% de las muestras se observó la presencia de la capa odontoblástica (ver figura 16).
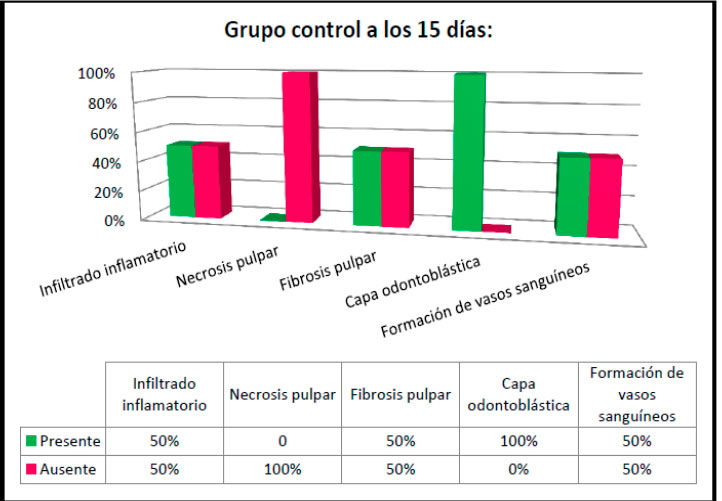 Figura 16: Hallazgos histológicos a los 15 días en el grupo control. Figura 16: Hallazgos histológicos a los 15 días en el grupo control.
Al evaluar los preparados histológicos del grupo experimental a los 15 días se observó en un 100% la ausencia de infiltrado inflamatorio y necrosis pulpar; solo el 50% de los casos presentó fibrosis pulpar y formación de vasos sanguíneos, no obstante se evidenció en el 100% de las muestras la presencia de la capa odontoblástica (Ver figura 17). 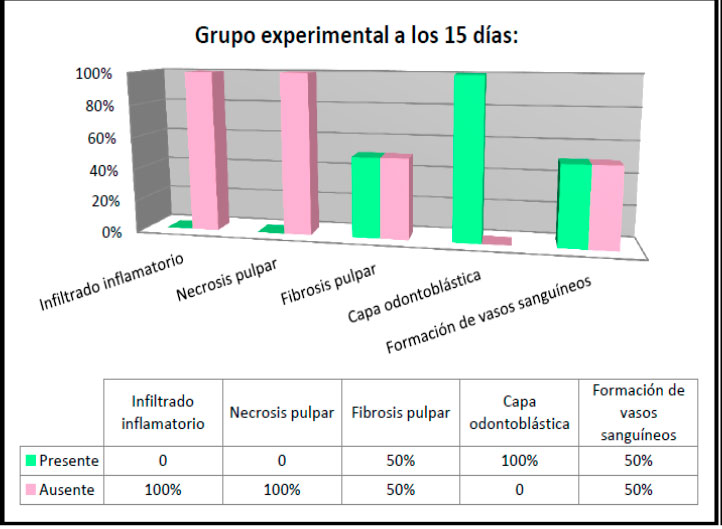 Figura 17: Hallazgos histológicos a los 15 días en el grupo experimental. En la evaluación histológica del grupo control al mes igualmente se logró observar 100% de la ausencia de infiltrado inflamatorio y necrosis pulpar; sin embargo en el 80% de los casos se evidenció la presencia de fibrosis pulpar y un 20% de formación de vasos sanguíneos, pero si hubo presencia de la capa odontoblástica en la totalidad de las muestras (ver figura 18). 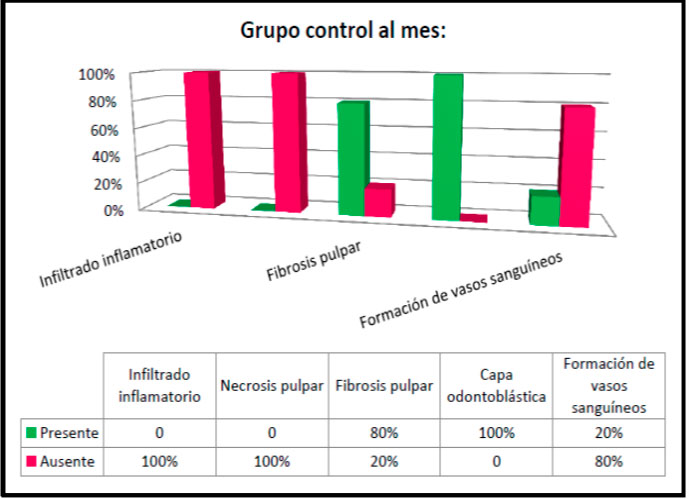 Figura 18: Hallazgos histológicos a los 30 días en el grupo control.
Se alcanzó observar en la evaluación histológica al mes del grupo experimental que hubo ausencia de infiltrado inflamatorio y necrosis pulpar en el 100% de las muestras, solo el 40% presentó fibrosis pulpar y un 20% de formación de vasos sanguíneos, sin embargo se mantuvo presente la capa odontoblástica en todos los casos (ver figura 19), además se evidenció la presencia de un canal con material rosado eosinófilico acelular (ver figura 15 ).Los hallazgos histológicos de ambos grupos se resumen en la figura 20. 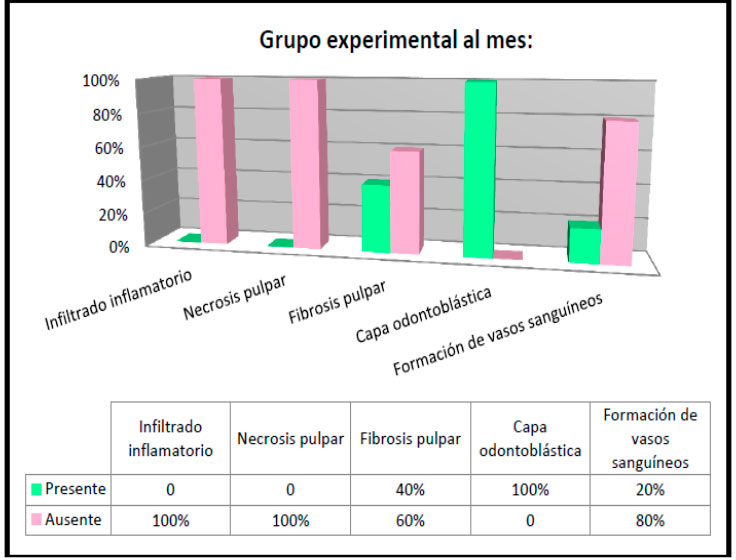 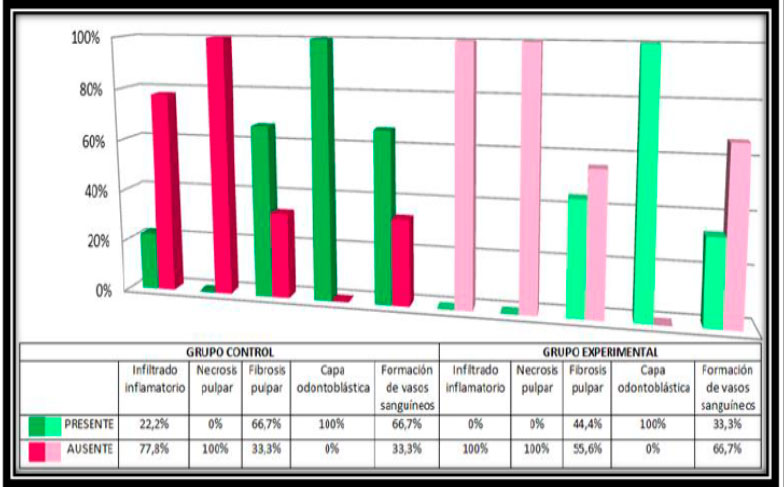 Figura 20: Resumen hallazgos histológicos generales del grupo control y experimental.
DISCUSIÓN
Actualmente, las técnicas de regeneración endodóntica posiblemente involucran la combinación de desinfección o desbridamiento del sistema de conductos infectados con ampliación apical, para permitir la revascularización y el uso de células madre adultas, soportes y factores de crecimiento, sin embargo la regeneración también puede ser aplicada sobre la pulpa expuesta para lograr la reparación y conservación de la vitalidad pulpar 4. La revascularización pulpar sería pues, un procedimiento endodóntico consistente en la completa eliminación del tejido pulpar necrótico e infectado y la desinfección del espacio pulpar de manera que se permita la revascularización del tejido pulpar a partir de las células madre pulpares vitales remanentes de la papila apical, alcanzándose la completa revascularización de la pulpa dental y la continuación del desarrollo radicular3. La terapia pulpar directa con concentrados plaquetarios parece ser una opción terapéutica prometedora para alcanzar esta regeneración dentinopulpar.
Los excelentes hallazgos histológicos encontrados en la presente investigación a los 15 y 30 días en ambos grupos difieren con los de Cortes (2001) 17 quien en su metodología en ratas menciona que en sus muestras en el lugar de la exposición se observaba una amplia zona de necrosis, se mantenía una inflamación moderada en el tejido pulpar y por debajo un tejido con poca estructura celular, así como calcificaciones distróficas y ausencia de regularidad en la capa odontoblástica, sólo en algunas muestras se insinuaba la presencia de un puente dentinario. Por otro lado, Giraldo (2014)1 refiere que el MTA a nivel celular induce el reclutamiento, proliferación y diferenciación de células madre mesenquimales pulpares para formar el puente dentinario y reduce la inflamación; a nivel molecular induce la secreción de factores angiogénicos como el factor de crecimiento vascular endotelial, que desempeña un papel importante en la cicatrización promoviendo la síntesis de colágeno, que resulta en una respuesta más organizada de la pulpa favoreciendo los procesos de cicatrización, teoría que podría explicar la bioestimulación celular observada en la pulpa del grupo control.
Aun cuando no se hallaron estudios similares en cuanto al empleo del iPRF para regeneración endodóntica, existen resultados obtenidos con el uso del PRP tanto en endodoncia como en otras áreas, Romero (2004)13, García (2004)23, Carrasco (2009)24, González (2012) 25, Rosales (2012)5, Camargo (2014)8 y Moguel (2015) 26, Jadhav (2015) 27 reportándose su gran utilidad para la cicatrización de tejidos blandos y duros, ya que es capaz de actuar sobre las células con capacidad de consolidación y de esta manera incrementar su número (actividad mitogénica) y estimular el crecimiento vascular interno (actividad angiogénico).
Los resultados obtenidos demostraron que no hubo predominio en la neoformación de vasos sanguíneos en el grupo experimental, ya que solo se presentó en el 33,3% de las muestras, lo cual puede ser debido a la avanzada etapa de reparación en la que se encontraba el complejo dentinopulpar, pues la respuesta vascular suele ser una respuesta de la fase aguda de la inflamación. Además, se ha mencionado que un foramen apical pequeño puede limitar el flujo sanguíneo, en estos casos se limita la revascularización pulpar 8 y en la pieza dentaria de la rata dicho foramen es diminuto.
Por otra parte, Chapple (2007)28, Giraldo (2014)1 y Moguel (2015)26 convergen en cuanto a que el MTA se ha sugerido como un material adecuado en el tratamiento de dientes vitales con exposición pulpar, la razón es su potencial de reparación del tejido remanente, biocompatibilidad, propiedad hidrofílicas y capacidad de selle relacionada a su insolubilidad; refieren que la actividad reparadora de la pulpa se produce más fácilmente por debajo de materiales que impiden la microfiltración bacteriana, una característica que favorece el uso de recubrimiento con MTA.
Los hallazgos encontrados en el grupo experimental concuerdan con los de Cortes (2001)23, Romero (2004)13, Rosales (2012)5, Camargo (2014)8 y Coa (2015) 29 donde visualizaron en sus estudios una importante proliferación de fibroblastos con un entramado de fibras de colágeno, dando lugar a un tejido conectivo fibroso. Además Camargo (2014)8, Bustos (2014)30 y Coa (2015) 29 hacen referencia a la producción de agentes anti-inflamatorios, que controlan la respuesta inflamatoria local, y mejora los tejidos blandos y duros en la cicatrización de las heridas.
CONCLUSIONES
El grupo tratado con iPRF mostró una respuesta de tipo reparativa al encontrarse abundantes células como los fibroblastos, así como un aumento en el número de las fibras colágenas provocando de esta manera un tejido conjuntivo pulpar denso.
En ambos grupos no hubo predominio de infiltrado inflamatorio, ni de formación de nuevos vasos sanguíneos; además se logró evidenciar la ausencia total de necrosis y el predominio de fibrosis pulpar, así mismo se observó la presencia regular de la capa odontoblástica. En el presente estudio, logró determinar que el complejo dentinopulpar con recubrimiento directo con PRP y MTA, producen una respuesta tisular favorable como es la reparación de ese complejo dentinopulpar. Se recomienda realizar ensayos clínicos controlados en humanos para evaluar la respuesta pulpar con el propósito de determinar la efectividad del iPRF en la regeneración dentinopulpar en pulpitis reversible. REFERENCIAS BIBLIOGRÁFICAS
1. Ramírez Giraldo T, Sossa Rojas H. Endodoncia regenerativa: Utilización de fibrina rica en plaquetas autóloga en dientes permanentes vitales con patología pulpar. Revisión narrativa de la literatura. Acta Odontológica Colombiana 2014; 4(1):91-112.
2. Gómez Palma, A. Regeneración endodóntica y revascularización pulpar. ¿Una buena alternativa en endodoncia? Revista Salud Quintana Roo 2012; 5(19):19-22.
3. Rodríguez Benítez S. Estudio sobre diferentes protocolos de irrigación y medicación intraconducto para la revascularización pulpar en dientes inmaduros y necróticos de perros beagle. Tesis doctoral. Universidad de Sevilla; 2015. 4. Camejo Suárez M. Ingenieria de tejido en la regeneracion de la dentina y la pulpa. Revision de la literatura. Acta Odontologica Venezolana 2010; 48 (1): 129-134. 5. Rosales Ibáñez R, Ojeda Gutiérrez F. Ingeniería Tisular en Odontología. Revista De La Asociación Dental Mexicana 2012; LXIX (4):164-167. 6. Nakashima M, Akamine A. The Application of Tissue Engineering to Regeneration of Pulp and Dentin in Endodontics. Journal of Endodontics 2005; 31(10):711-8. 7. Chartier C. Seminario: Protocolos de Revascularización utilizados desde el inicio a la Actualidad. Seminario de postgrado en endodoncia. Universidad de Valparaíso Chile; 2013. 8. Camargo Guevara P, Sossa Rojas H. Revascularización pulpar mediante la utilización de plasma rico en plaquetas autólogo o en combinación con una matriz colágena, como posibilidades terapéuticas para dientes con ápice abierto, pulpa necrótica y/o patología periapical: Revisión narrativa de la literatura. Acta Odontológica Colombiana 2014; 4(1): 113-129. 9. Quiñones Márquez D. Patologías pulpares y periapicales en urgencias en 2 clinicas estomatológicas. Revista Cubana De Estomatológica 2000; 37(2):84-8. 10. López Marcos J. Etiología, clasificación y patogenia de la patología pulpar y periapical. Medicina Oral, Patololgia Oral y Cirugia Bucal 2004; 9:52-62.
11. Demarc F, Muñíz M, Neves B. Dental Pulp Tissue Engineering. Brazilian Dental Journal 2011; 22(1):3-14. 12. Anitua E, Sanchez M, Alan T. New insights into and novel applications for platelet-rich fibrin therapies. Elsevier, 2006; 24(5):227-34. 13. Dohan D, Choukroun J, Diss A. Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part I: Technological concepts and evolution. Pathology Oral Radiologic and Endodontics 2006; 101(3):37-44. 14. Romero Márquez R . Análisis histológico de la regeneración in vivo del complejo pulpodentinario humano con ingienieria tisular autológa. Odontología Sanmarquina 2004; 8(1):10-13. 15. Hernández R, Fernández C y Baptista P. Metodología de la Investigación. 4ta ed. México: Mc Graw Hill; 2006. 16. Hurtado de B, Jacqueline. Metodología de la Investigación, una Comprensión Holística.4ta ed. Caracas: Ediciones Quirón; 2008. 17. Cortés O, Metodología para estudios histológicos pulpares en ratas. Revista Endodoncia. 2001; 19(1):31-39. 18. Björnal L, Mjör I. Pulp-dentin biology in restorative dentistry. Part 4: Dental caries-characteristics of lesions and pulpal reactions. Quintessence International 2001; 32(9). 19. Horsted P, El-Ahark K, Langeland K. Capping of monkey pulps with dycal and a Ca-eugenol cement. Oral Surg Oral Med Oral Path 1981; (52):531-553. 20. Fuks A, Bimstein E, Michaeli Y. Glutaraldehyde as a pulp dressing after pulpotomy in primary teeth of baboon monkeys. Pediatr Dent 1986;(8):32-36. 21. Sasaki T, Kawamata-kido H. Providing an environment for reparative dentine induction in amputated rat molar pulp by high molecular-weight hyaluronic acid. Archives of oral biology 1994; (40):209-219. 22. Berman C, Massler M. Experimental pulpotomies en rat molars. Journal of dental research. 1958; 229 23. García V, Corral L, Bascones A. Plasma Rico en Plaquetas y su utilización en implantología dental. Av Períodon Implanto. 2004; 16,2: 81-92. 24. Carrasco J. Plasma Rico en Plaquetas vs. Plasma rico en factores de crecimiento. Revista Española de Cirugía Osteoarticular 2009; 46(239):127-140. 25. González M, Arteaga M. Aplicación del plasma rico en plaquetas (PRP) y sus derivados en implantología dental y cirugía plástica. Investigación Clínica. 2012; 53(4): 408-418
26. Moguel J, Contreras J, Muñoz M. Terapia pulpar Vital con Fibrina Rica en Plaquetas: Pulpotomía, Alternativa en Endodoncia. Reporte de un caso. Universidad Anáhuac Mayab. Revista ADM Estudiantil. 2015 (10):13-20. 27. Jadhav G, Shah N, Logani A. Revascularization with and without Platelet-rich Plasma in Nonvital, Immature, Anterior Teeth: A Pilot Clinical Study. Journal of Endodontics 2012; 38(12):1581-1587. 28. Chaple A, Herrero L. Generalidades del agregado de trióxido mineral (MTA) y su aplicación en odontología: Revisión de la literatura. Acta Odontológica Venezolana 2007; 45 (3):1-8. 29. Coa P, Castillo D. Uso del plasma rico en plaquetas y respuesta tisular sobre la pulpa dental humana. Revista científica "Filial Arequipa" 2015; 1 (1): 60-70. 30. Bustos Orozco L. Revascularización pulpar en dientes permanentes con ápice abierto por medio de la utilización de plasma rico en plaquetas en combinación con soportes de colágeno tipo I: estudio descriptivo. Universidad Nacional de Colombia; 2014.
|

















 Figura 16: Hallazgos histológicos a los 15 días en el grupo control.
Figura 16: Hallazgos histológicos a los 15 días en el grupo control.


