Autores:
Díaz-Daza Adela1, Rubia-Gómez Rodrigo2, San Martín-Galindo Laura3.Información de autor:
1 Alumna 5o curso Grado en Odontología, Universidad Europea Miguel de Cervantes. Autor de correspondencia: adiaz7292@alumnos.uemc.es
2 CEO Blonde Biotech, Valladolid.
3 Profesora Departamento Ciencias de la Salud, Universidad Europea Miguel de Cervantes. INTRODUCCIÓN:
La enfermedad periodontal (EP) es una enfermedad crónica y multifactorial en la que interactúan el ambiente y los factores del huésped. El componente genético juega un papel clave en el inicio de la EP, de hecho, el material genético puede modular la inflamación de las membranas mucosas y la pérdida de hueso alveolar. Estudios previos sugieren una asociación fuerte entre su aparición y el perfil genético individual. El papel de la susceptibilidad genética podría afectar a las manifestaciones clínicas de la EP y, en consecuencia, a la prevención y la terapia de la misma1.
EP se caracteriza por la destrucción de los tejidos de apoyo de los dientes a partir de un cambio de la composición de las bacterias del biofilm (de aeróbico a anaerobio) y desencadenan la respuesta inmune. Sin embargo, las mismas bacterias periodontales pueden o no causar la recurrencia de esta. Por lo tanto, está claro que los factores genéticos podrían desempeñar un papel crucial en la modulación de diferentes formas de EP1.
Las investigaciones sobre la genética y la EP empezaron hace unos 30 años. La respuesta inmune del individuo a las bacterias periodontales es mediada por factores genéticos. Esta relación se puede considerar elemento fundamental en la patogenia y la progresión de la EP1,2.
Algunos genes fueron analizados para comprobar la susceptibilidad a la EP y si son responsables de la misma. Al ser una enfermedad multifactorial, los factores genéticos y ambientales (higiene bucal, tabaquismo, dieta de estrés, etc.) interactúan entre sí y ante desequilibrios severos de este para desarrollar esta enfermedad haciendo que las rutas genéticas que derivan en los productos de los genes (enzimas, proteínas...) se vean truncadas o sobreexpresadas, lo que hace que la susceptibilidad a la EP u otras enfermedades aumente de forma exponencial1,2.
La forma más leve de la enfermedad periodontal, es decir, la gingivitis, tiene una patología simple. El estado inflamatorio es causado por una biopelícula bacteriana oral (placa dental) que se acumula en los dientes adyacentes a la encía. Si la gingivitis no se trata apropiadamente, conduce a la periodontitis, que induce la pérdida alveolar del hueso y del diente. Dado que la gingivitis es reversible, la detección precoz de esta juega un papel importante en el tratamiento clínico exitoso y, en última instancia, conduce a una mayor tasa de supervivencia dentaria. Controlarla lo antes posible puede reducir los impactos severos más adelante en la vida3.
Actualmente, el diagnóstico de la gingivitis se basa en muestras clínicas de la inflamación gingival (edema gingival, sangrado al sondaje y aumento del líquido crevicular que se mezcla con la saliva). Sobre su contenido, la saliva cuenta con diversas sustancias biológicas, y puede poseer el potencial de servir como herramienta de diagnóstico para las enfermedades orales4. Varias proteínas salivales, como la interleucina (IL)-1 β, la matriz metaloproteinasa (MMP)-8, y la piridinolina reticulada carboxiterminal telopéptido del colágeno tipo I (ICTP), se han utilizado con éxito en la detección de la actividad periodontal de la enfermedad5,6. Sin embargo, como estas proteínas están asociadas con la degradación extensa del colágeno y la activación de los osteoclastos7,8, no reflejan la iniciación de la gingivitis. A nivel molecular, la iniciación y la resolución de la inflamación gingival son reguladas por las quimiocinas y citoquinas. Los primeros pasos en este proceso inflamatorio son el aumento del flujo sanguíneo y la vascularización (angiogénesis), aumento de la permeabilidad vascular y migración de neutrófilos y monocitos/macrófagos al sitio de infección9. OBJETIVOS:
El propósito de la presente revisión bibliográfica es caracterizar los niveles salivales de las citoquinas proinflamatorias seleccionadas asociadas con la gingivitis, con el fin de probar la hipótesis de que la inflamación gingival en estadio inicial tiene un impacto sobre las concentraciones salivales de determinadas citoquinas. MATERIAL Y MÉTODOS:
Para la realización del presente estudio se ha realizado una búsqueda bibliográfica en la base de datos PubMed (https://www.ncbi.nlm.nih.gov/pubmed) y Web of Science (https://www.recursoscientificos.fecyt.es).
Los criterios de inclusión para la selección de artículos consultados en este estudio han sido: selección de artículos originales experimentales basados en el uso de rutas genéticas y estudios salivares relacionados con la enfermedad periodontal, revisiones bibliográficas y revisiones sistemáticas, utilizando como palabras clave: "genetics", "salivary" y "periodontal diseases" en idioma inglés y texto completo disponible. La búsqueda se ha limitado a artículos publicados entre los años 2006 y 2017 ambos inclusive.
Los criterios de exclusión han sido: artículos basados en opiniones de expertos y estudios que no cumplieran los criterios de inclusión anteriormente mencionados. RESULTADOS:
El resultado contrastado principal tras la revisión de la literatura y aplicando los criterios de inclusión/exclusión, es que la gingivitis temprana está asociada a una disminución significativa de las concentraciones salivales de todas las citoquinas investigadas.
Se seleccionaron artículos con similares características de estudio aplicadas a un amplio grupo heterogéneo de pacientes en cuanto a edad, sexo, raza/etnia, con y sin hábitos nocivos (fumadores) y con diferentes estados de salud gingival.
Se muestra un ejemplo (Ebersole et al. 2015) de los perfiles de las citoquinas salivales analizadas IL-1ß, IL-6, MMP-8 y MIP-α (figura 110). Se encontraron concentraciones significativamente mayores de Il-β en el grupo de periodontitis (102,3 ± 10,1 sem pg/ml) en comparación con los niveles en la gingivitis (28,7 ± 7,3) y los sujetos sanos (14,6 ± 2,6). Se observó una diferencia mínima en el que compara el grupo total de la gingivitis a los individuos sanos. De manera similar, se encontró una concentración significativamente elevada de IL-6 salival en el grupo de periodontitis (22,8 ± 3,7 pg/ml) en comparación con la gingivitis (6,3 ± 2,7) y los sujetos sanos (3,7 ± 0,5). De acuerdo con esto, los niveles IL-6 estuvieron por debajo del nivel de detección en el ensayo (0,64 pg/ml) en el 2% de los pacientes con periodontitis aproximadamente, en comparación con la gingivitis con casi el 20% y los sujetos sanos. Los niveles de MMP-8 también se elevaron significativamente en el grupo de periodontitis (314,1 ± 25,5 ng/ml) en comparación con los sujetos de gingivitis (199,0 ± 29,1) y sanos (130,7 ± 14,5). Finalmente, el MIP-α se incrementó significativamente en el grupo de periodontitis (16,2 ± 2,2 pg/ml) en comparación con los grupos de gingivitis (12,0 ± 2,2) y de salud (3,2 ± 1,0). DISCUSIÓN:
Los estudios que se realizaron en los últimos años facilitaron una serie de fines para la detección de diversas y variadas sustancias en la saliva (Desai y Mathews, 2014); incluyendo, por ejemplo, drogas de abuso (Moore y Crouch, 2013), alcohol (SWIFT, 2003), cortisol (Van Andel et al., 2014), y anticuerpo VIH (bragas PAI et al., 2012).
Basándose en el interés potencial de la saliva como instrumento de cribado no invasivo para las enfermedades orales, esta revisión bibliográfica se centró en la cuantificación de una serie de analitos que pueden trabajar como biomarcadores en la enfermedad periodontal y ayudar en el desarrollo de planes de tratamiento personalizados para evaluación de riesgos periodontales.
La evolución hacia una era de determinaciones clínicas individualizadas y de medicina personalizada en periodoncia, requieren un perfeccionamiento y mejora significativos en nuestra capacidad para definir los riesgos y predecir el avance de la enfermedad.
Mientras que, en el campo médico, comúnmente se hacen diagnósticos clínicos basados en signos y síntomas (por ejemplo, diarrea o neumonía), la medicina moderna une los descriptores clínicos clásicos con la carga biológica que permite al facultativo centrarse en la etiología concreta de la enfermedad y las características individuales del paciente para trazar una línea de diagnóstico y tratamiento específicos.
Las investigaciones más actuales que usan análisis proteómico y transcriptómico han ampliado el potencial de los biomarcadores para la gingivitis; no obstante, estos estudios generalmente se han limitado a mostrar comparaciones de gingivitis con salud, o de periodontitis con salud (Offenbacher et al., 2009; Jönsson et al., 2011).
La periodontitis es una respuesta inflamatoria persistente a los biofilms, crónica y que residen en la zona subgingival (Hajishengallis, 2014; Nibali et al., 2014). El modelo actual sugiere que las variaciones en la cantidad y la calidad de la flora microbiana oral en la salud, la gingivitis, y la periodontitis da lugar a una respuesta inflamatoria descontrolada que causa la liberación de diversas biomoléculas que conducen a las características clínicas de periodontitis del huésped. Estas, pueden representar las diferentes etapas de la progresión de la respuesta inflamatoria destructiva, incluyendo IL-1ß como citoquina proinflamatoria que tiene efectos en la biología del hueso (Nakashima y Takayanagi, 2009; Braun y Schett, 2012), IL-6 como citoquina que comunica las señales inflamatorias con algunos tipos de células, y puede provocar procesos de reabsorción ósea (Huang et al., 2001; Braun y Schett, 2012); MMP-8, una colagenasa primaria efectiva en los tipos de colágeno I y III, liberada por los neutrófilos que alteran la integridad de los tejidos blandos en el periodonto (Salminen et al., 2014), y el MIP-α (CCL3), macrófago proinflamatorio que se une a los receptores CCR1, CCR4 y CCR5 en la superficie de las células inmunitarias frecuentemente, y las recluta en los lugares de inflamación (Kabashima et al., 2001).
Muchos de estos biomarcadores se han detectado en la saliva, correlacionándose así con la enfermedad periodontal. Está claro que estas biomoléculas contribuyen a los procesos destructivos inflamatorios y tisulares de la periodontitis, sin embargo, el historial médico-clínico se debe tener en cuenta para reducir al mínimo respuestas falso-positivas en pacientes periodontalmente sanos. CONCLUSIÓN:
La determinación de los biomarcadores en la saliva se está convirtiendo en una parte importante de los diagnósticos de laboratorio y la predicción no sólo periodontal, sino también en otras enfermedades. Estos biomarcadores (enzimas, marcadores de proteínas) se pueden utilizar para la determinación de la actividad y para el pronóstico periodontal de la enfermedad.
Es importante mencionar que una ventaja del uso de la saliva como material de diagnóstico, es que se puede obtener para pruebas de laboratorio de forma no invasiva y repetidamente. BIBLIOGRAFÍA:
1. Tettamanti L, Gaudio RM, Iapichino A, Mucchi D, Tagliabue A. Genetic susceptibility and periodontal disease: a retrospective study on a large.
2. Belstrøm D, Damgaard C, Könönen E, Gürsoy M, Holmstrup P, Gürsoy UK. Salivary cytokine levels in early gingival inflammation. J Oral Microbiol [Internet]. 2017 [cited 2017 Nov 9];9(1):1364101.
3. Ekuni D, Yamane-Takeuchi M, Kataoka K, Yokoi A, Taniguchi-Tabata A, Mizuno H, et al. Validity of a New Kit Measuring Salivary Lactate Dehydrogenase Level for Screening Gingivitis. Dis Markers [Internet]. 2017 [cited 2017 Nov 9];2017:1-6.
4. Gursoy UK, Kononen E. Editorial: use of saliva in diagnosis of periodontitis: cumulative use of bacterial and host-derived biomarkers. Front Cell Infect Microbiol. 2016;6:196.
5. Gursoy UK, Kononen E, Pradhan-Palikhe P, et al. Salivary MMP-8, TIMP-1, and ICTP as markers of advanced periodontitis. J Clin Periodontol. 2010;37(6):487-493.
6. Jaedicke KM, Preshaw PM, Taylor JJ. Salivary cytokines as biomarkers of periodontal diseases. Periodontol 2000. 2016;70(1):164-183.
7. Syndergaard B, Al-Sabbagh M, Kryscio RJ, et al. Salivary biomarkers associated with gingivitis and response to therapy. J Periodontol. 2014;85(8):e295-e303.
8. Graves DT, Li J, Cochran DL. Inflammation and uncoupling as mechanisms of periodontal bone loss. J Dent Res. 2011;90(2):143-153.
9. Cekici A, Kantarci A, Hasturk H, et al. Inflammatory and immune pathways in the pathogenesis of periodontal disease. Periodontol 2000. 2014;64(1):57-80
10. Ebersole JL, Nagarajan R, Akers D, Miller CS. Targeted salivary biomarkers for discrimination of periodontal health and disease(s). Front Cell Infect Microbiol [Internet]. 2015 Aug 19 [cited 2018 Jan 21];5:62.
11. Sánchez GA, Miozza VA, Delgado A, Busch L. Total salivary nitrates and nitrites in oral health and periodontal disease. Nitric Oxide [Internet]. 2014 Jan 30 [cited 2018 Jan 21];36:31-5.
12. Chauhan A, Yadav SS, Dwivedi P, Lal N, Usman K, Khattri S. Correlation of Serum and Salivary Cytokines Level With Clinical Parameters in Metabolic Syndrome With Periodontitis. J Clin Lab Anal [Internet]. 2016 Sep [cited 2018 Jan 21];30(5):649-55.
13. Silvestre-Rangil J, Bagán L, Silvestre FJ, Bagán JV. Oral manifestations of rheumatoid arthritis. A cross-sectional study of 73 patients. Clin Oral Inve
14. Sánchez G, Miozza V, Delgado A, Busch L. Relationship between salivary mucin or amylase and the periodontal status. Oral Dis [Internet]. 2013 Sep [cited 2018 Jan 21];19(6):585-91.
15. Nakamura-Kiyama M, Ono K, Masuda W, Hitomi S, Matsuo K, Usui M, et al. Changes of salivary functions in experimental periodontitis model rats. Arch Oral Biol [Internet]. 2014 Feb [cited 2018 Jan 21];59(2):125-32.
16. Salminen A, Gursoy UK, Paju S, Hyvärinen K, Mäntylä P, Buhlin K, et al. Salivary biomarkers of bacterial burden, inflammatory response, and tissue destruction in periodontitis. J Clin Periodontol [Internet]. 2014 May [cited 2018 Jan 21];41(5):442-50.
17. Sánchez G, Miozza V, Delgado A, Busch L. Relationship between salivary mucin or amylase and the periodontal status. Oral Dis [Internet]. 2013 Sep [cited 2017 Dec 21];19(6):585-91.
18. Nakamura-Kiyama M, Ono K, Masuda W, Hitomi S, Matsuo K, Usui M, et al. Changes of salivary functions in experimental periodontitis model rats. Arch Oral Biol [Internet]. 2014 Feb [cited 2017 Dec 21];59(2):125-32.
19. Salminen A, Gursoy UK, Paju S, Hyvärinen K, Mäntylä P, Buhlin K, et al. Salivary biomarkers of bacterial burden, inflammatory response, and tissue destruction in periodontitis. J Clin Periodontol [Internet]. 2014 May [cited 2017 Dec 21];41(5):442-50.
20. Chauhan A, Yadav SS, Dwivedi P, Lal N, Usman K, Khattri S. Correlation of Serum and Salivary Cytokines Level With Clinical Parameters in Metabolic Syndrome With Periodontitis. J Clin Lab Anal [Internet]. 2016 Sep [cited 2017 Dec 21];30(5):649-55.
21. Acharya A, Koh ML, Kheur S, Watt RM, Jin L, Mattheos N. Salivary IL-1β and red complex bacteria as predictors of the inflammatory status in sub-peri-implant niches of subjects with peri-implant mucositis. Clin Oral Implants Res [Internet]. 2016 Jun [cited 2017 Dec 21];27(6):662-7. TABLAS Y FIGURAS:
Figura 1
Distribución de los niveles de IL-1ß (A), IL-6 (B), MMP-8 (C), y MIP-α (D) en los tres grupos de sujetos. Cada punto muestra el valor del analito para un paciente. La línea roja vertical denota la media del grupo y la línea azul vertical discontinua muestra el límite de umbral para cada analito (IL-1ß ≥ 28 pg/ml; IL-6 ≥ 5,5 pg/ml; MMP-8 ≥ 140 ng/ml; MIP-α ≥ 5 pg/ml). 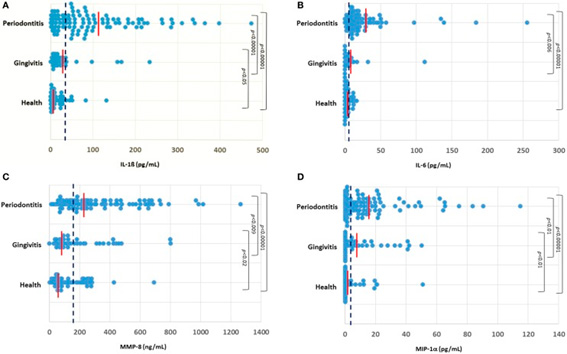
|
