MISCIBILIDAD DEL QUITOSANO UNIDO CON METRONIDAZOL PARA LA LIBERACIÓN CONTROLADA EN MEMBRANAS DE USO PERIODONTAL |
Publicado el: 10/12/2014 13:20:02 |
Gladys Velazco1, Reynaldo Ortiz2, Anajulia Gonzalez1
1. Centro de Investigaciones Odontológicas, Facultad de Odontología, Universidad de Los Andes, Mérida Venezuela 2. Laboratorio de Electroquímica Fundamental y Aplicada, Facultad de Ciencias, Universidad de Los Andes. Correspondencia: Calle 23 entre avenidas 2 y 3 Edificio Adjunto al Rectorado, Facultad de Odontología Universidad de Los Andes Mérida, Venezuela. Email:gvelazco@ula.ve
RESUMEN El quitosano (Q) es un polisacárido natural, cuya estructura corresponde a un copolímero de N-acetilglucosaminas y glucosaminas, biodegradable, biocompatible, se ha utilizado como membrana proveyendo una técnica sencilla para su colocación brindándole al operador la certeza de aplicar la dosis necesaria en el sitio de la lesión El metronidazol (MTZ) es antibiótico y antiparasitario del grupo de los nitroimidazoles inhibe la síntesis del ácido nucleico y es utilizado para el tratamiento de las infecciones provocadas por protozoarios y bacterias anaeróbicas. Con la finalidad de analizar la miscibilidad del quitosano en solución, cuando se une con medicamentos al ser utilizado en la liberación controlada de fármacos, se propone la unión de quitosano con metronidazol al 99.9 %. La unión se realiza en 15 ml de quitosano filtrado agregandole una dosis de administración del antibiótico, lo que significa que en el caso del metronidazol a 15ml de solución se le agregara 2 mg del antibiótico a un 99.9% de pureza (Valmorca, Mérida - Venezuela), el procedimiento siguiente será el indicado para formar las películas por evaporación las que serán analizadas en microscopia electrónica de barrido (MEB) para verificar la no producción de una tercera especie química se realizó espectroscopia de rayos x (EDX) y una voltametría de pulso diferencial para verificar la liberación controloda del MTZ . El examen morfológico demostró la miscibilidad del compuesto, el EDX comprobó la no formación de terceras especies que pudiesen afectar la estructura. La respuesta voltamétrica fue apropiada demostrando la liberación del compuesto cada media hora. Palabras Clave:Quitosano, Metronidazol, Liberación, Membranas. Biopolímero.
MISCIBILITY OF CHITOSAN WITH METRONIDAZOLE FOR THE RELEASE CONTROLLED USE PERIODONTAL MEMBRANES.
Chitosan (Q) is a natural polysaccharide, whosestructurecorrespondsto a copolymer of N-acetilglucosaminas and Glucosamine, biodegradable, biocompatible, used as membraneproviding a simple techniqueforplacementprovidingtheoperatorcertaintyapplythedosage at thesite of thelesion (MTZ) metronidazoleantibiotic and antiparasitic of nitroimidazolegroupinhibitsnucleicacidsynthesis, and itisusedforthetreatment of infectionscausedbyanaerobic bacteria and protozoa. In ordertoanalyzethemiscibility of Chitosansolution, whenitjoinswithmedicationsbeingused in thecontrolledrelease of drugs, isproposedtheunion of Chitosanwithmetronidazoleto 99.9%. Theunionisachieved in 15 ml of Chitosanfilteradding a dose of antibioticadministration, whichmeans 2 mg of theantibioticto 99.9 - to be added in the case of metronidazoleto 15 ml of solution % purity (Valmorca, Mérida - Venezuela), thefollowingprocedureshall be as specifiedtoform films byevaporationwhichwill be analyzed in microscopyElectron (SEM) toverifythe non-production of a thirdchemicalspeciesheldspectroscopy x-ray (EDX) x and a voltammetry of pulse differentialtoverifythereleasecontroloda of the MTZ. Themorphologicalexaminationshowedthemiscibility of thecompound, the EDX foundformation of thirdspecieswhichmightimpairthestructure. Voltamétrica response wasappropriateshowingtherelease of compoundeveryhalfhour. Key words: Chitosan, metronidazole, liberation, membranes, Biopolimer.
INTRODUCCION El quitosano (Q) es un polisacárido natural, cuya estructura corresponde a un copolímero de N-acetilglucosaminas y glucosaminas, biodegradable, biocompatible, que se obtiene a partir de la quitina, formando parte del exoesqueleto de crustáceos, insectos y paredes celulares de hongos. Debido a la compatibilidad del quitosano con muchos compuestos orgánicos como surfactantes, almidones, sales de amonio cuaternario, polímeros catiónicos y no iónicos además de aniones polivalentes, se pueden formar geles y precipitados (1). La naturaleza catiónica, o estado de oxidación positivo del polímero permite formar complejos con fármacos o excipientes de carga opuesta (2). El quitosano se ha estudiado por su posible papel en la liberación controlada de principios activos y por su habilidad para formar geles, pero también, se le ha visto utilidad en formas de dosificación de liberación rápida. Se ha ensayado el polímero en un alto grado de desacetilación, como excipiente para comprimidos, pero esta aplicación es limitada, debido a que no presenta propiedades reológicas y de compresibilidad adecuadas (1). Debido a su alto peso molecular y a su estructura lineal no ramificada, el quitosano es un potente agente viscosizante en medio ácido y se comporta como un material pseudoplástico, con viscosidad dependiente de la agitación. La viscosidad de las soluciones de quitosano aumenta al incrementar la concentración de éste, mientras que disminuye al elevar la temperatura y el grado de desacetilación del producto. Es insoluble a pH alcalino y neutro, siendo soluble sólo en ácidos, sobre todo en ácidos orgánicos, presentando solubilidad limitada en ácidos inorgánicos. En disolución, los grupos amino del polímero se protonan dando como resultado un polisacárido soluble cargado positivamente (R-NH3+) (1 ,2). Por otra parte, las sales de quitosano (con glutamato o cloruro) son solubles en agua, siendo la solubilidad dependiente del grado de desacetilación del quitosano. Así, con bajo grado de desacetilación, llega a ser soluble hasta pH = 9,0 mientras que con un grado de desacetilación alto es soluble hasta pH = 6,5 (2).El quitosano utilizado como membrana provee una técnica muy sencilla para su colocación brindándole al operador la certeza de que se aplique la dosis necesaria en el sitio de la lesión, acompañado de estudios que demuestran la alta efectividad en el tratamiento en la periodontitis crónica entre otras afecciones periodontales(3), así como en la regeneración osteomucosa después de la extracción de terceros molares incluidos (4), regeneración dérmica de pacientes con pie diabético (5), en la regeneración ósea de implantes de óseo integrados (6). Los nitroimidazoles son derivados de imidazol que contienen un grupo nitro en su estructura. Algunos de ellos constituyen una clase de antibióticos que se han utilizado para atacar bacterias anaeróbicas e infecciones parasitarias. Los nitroimidazoles se pueden clasificar en dos tipos: los 5-nitro y los 2-nitroimidazoles. Solamente los 5-nitro derivados, son útiles como antibacterianos y antiparasitarios, mientras que ambos grupos potencian el efecto de las radiaciones sobre tumores de centro necrótico (anóxicos) (7).La reducción del grupo nitro (-NO2), parece ser necesaria para que se produzca el efecto bactericida o parasiticida (8), siendo activados en el interior de las células sensibles, por la ferrodoxina del parásito, formando un compuesto reactivo que interfiere en el transporte de electrones y rompe el ADN (7,8).El espectro antibacteriano y antiprotozoario de los nitroimidazoles es el siguiente; para el caso de las bacterias, abarca solamente las bacterias anaerobias, tanto gram (-) como gram (+) (7). El metronidazol es un antibiótico y antiparasitario del grupo de los nitroimidazoles Inhibe la síntesis del ácido nucleico y es utilizado para el tratamiento de las infecciones provocadas por protozoarios y bacterias anaeróbicas. En la actualidad el Metronidazol es utilizado para una amplia variedad de patologías como abscesos cerebrales, endocarditis infecciosas, infecciones óseas, articulares, pleuropulmonares y cutáneas. Se emplea como tratamiento profiláctico en infecciones quirúrgicas, tratamientos de periodontitis y gingivitis, colitis C y giardiasis(8). Es la droga patrón de los 5-nitroimidazoles, y con la que se tiene mayor experiencia clínica (9).Con la finalidad de analizar la miscibilidad del quitosano en solución, cuando se une con medicamentos al ser utilizado en la liberación controlada de fármacos, se decidió proponer la unión de la sal de quitosano con metronidazol al 99.9 %. METODOLOGIA Para las películas de quitosano se preparara una solución de quitosano pesando 5 gquitosano, certificado para uso médico de la casa GUINAMA, Quitosan®, en una solución acida constituida por 2 ml ácido acético al 99%, y agua en c.s.p. para 250 ml, dejándose en agitación constante por 12 horas y obteniendo un gel de quitosano ácido, posteriormente esta solución es colocada en placas de Petri para ser llevadas a una estufa de calor seco y obtener películas por evaporación de la fase acuosa (acido) siendo posteriormente neutralizadas con NaOH 0.5% y recortadas dependiendo de las necesidades clinicas . La unión se propuso de la siguiente manera a 15 ml de quitosano filtrado se le agregara una dosis de administración del antibiótico, lo que significa que en el caso del metronidazol a 15ml de solución se le agregara 2 mg del antibiótico a un 99.9% de pureza (Valmorca, Mérida - Venezuela), el procedimiento siguiente será el indicado para formar las películas por evaporación FIGURA 1. 1a. Quitosano mezclado con metronidazol, 1b. Membrana de quitosano en la placa de petri.
Las películas realizadas fueron estudiadas con microscopia electrónica de barrido para analizar posibles variaciones en la superficie, en la preparación de las mezclas en las disoluciones de ambos compuestos quitosano y metronidazoleran claramente homogéneas, lo cual es indicativo de una separación de fases. Para su análisis, las películas fueron recortadas obteniéndose cuadros de 1 x 1 cm de área, cubriéndolas con una capa de oro por 15 min, metalizado indispensable, porque además de hacer conductiva la superficie, elimina la electricidad estática, minimiza el daño por radiación y aumenta la reflectividad electrónica. Igualmente se realizó una espectrometría por dispersión de rayos X (EDX).
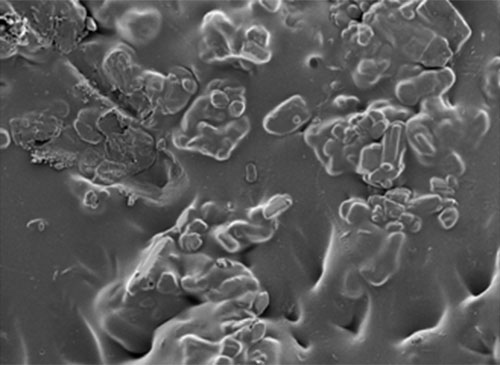
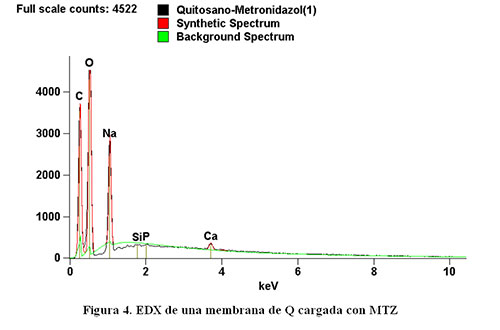
RESULTADOS Y DISCUSION En la figura 2 se observa la matriz de quitosano con metronidazol a una magnificación de 100X donde hay una visible presencia de gránulos inmersos en una matriz que se deben probablemente a la acumulación del principio farmacéutico dentro del polímero, zonas favorables ya que estas zonas generaran mayor atracción de iones (11) Figura 2.Microfotografía de la Matriz de quitosano con MTZ 100X En la figura 3 a una magnificación de 500X ya se observa una clara combinación de fases donde la matriz del quitosano sigue envolviendo el compuesto antibiótico demostrado por las múltiples irregularidades presentes.Estas características mejoran la adhesión celular y la bacteriana. Al incorporar el antibiótico en la película la protonación del material también se modifica con la incorporación de este compuesto (10) el acercamiento bacteriano y la liberación del medicamento potenciarían la eliminación de infección. El examenmorfologicoes de gran importancia en vista de quenospermiteverificar la presencia de fases y esdirectamenteproporcional a la funcionalidadde losmaterialescoincidiendo con otrosestudioses la mejor forma de analizar la estructuramorfologica de un compuesto (11) Figura 3. MicrofotografíaMatriz de quitosano com MTZ 500X El EDXfigura 4 realizado a estas películas demuestralaestabilidaddelcompuesto al no reaccionar formando otras espécies, demostrando asi que launión entre ambos es física y estableexistiendocantidades importantes de Na, O y C componentes principales tanto delquitosano como delmetronidazol, demostrandose que no hay elementos toxicos formando parte delcompuesto, niformacion de terceras espécies toxicas (7,8).
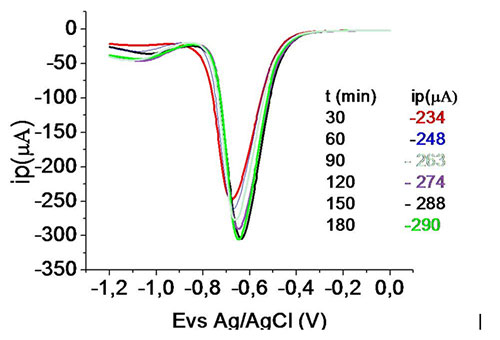
La liberación del medicamento en el medio fue calculada con una técnica devoltametria de pulso diferencial figura 5. A través de la técnica se midió la corriente resultante de una serie de soluciones patrones de MTZ puro a distintas concentraciones que van de 2x10-4 a 8x10-3 M, lográndose ver un aumento gradual de la corriente pico a medida que aumenta la concentración, por lo tanto, la corriente esproporcional al cambio en la concentración de MTZ. El desprendimiento del MTZ en el tiempo desde una membrana de Q se demuestra en un aumento gradual de la corriente pico como se observa en el voltamperograma de pulso diferencial figura 8, es decir, que aumenta la concentración del MTZ en el seno de la solución a medida q transcurre el tiempo, lo que ya nos indica la liberación del MTZ desde la membrana de quitosano cada treinta minutos, coincidiendo con estudios reportados con resultados similares (1). Figura 5. Voltagrama de pulso diferencial deMTZ patrón a diferentes concentraciones en salivaartificial pH 4,8 a 370C. Amplitud= 100mv, anchode pulso 25ms, velocidad de barrido= 10mv/s CONCLUSION
REFERENCIAS 1. Arias B, Ortiz R, Velazco G. Determinación de la velocidad de liberación de metronidazol incorporado en membranas de quitosano utilizando voltametria de pulso diferencial. Acta Bioc. 2012, 2(3):69-93
|
Publicado el: 10/12/2014 13:20:02 |