REGENERACIÓN OSTEOMUCOSA CON MEMBRANA DE QUITOSANO: REPORTE DE UN CASO. |
|||||||||||||||||||||||||
Publicado el: 28/04/2011 18:33:39 | |||||||||||||||||||||||||
REGENERACIÓN OSTEOMUCOSA CON MEMBRANA DE QUITOSANO: REPORTE DE UN CASO.Dubraska Suárez1, Carlos García 2, Jenair Yépez 3, Anajulia González 4, Gladys Velazco 5.
Facultad de Odontología, Calle 23 entre avenidas 2 y 3, Departamento de Investigación, Universidad de Los Andes (ULA), Mérida-Venezuela. Telef.: 0274-2402379. E-mail: gvelazco@ula.ve
RESUMEN La regeneración osteomucosa guiada (ROG) usando membranas de quitosano, excluye células del epitelio gingival y conectivo en el proceso de cicatrización, favoreciendo la regeneración mediante principios activos y un correcto ordenamiento del tejido regenerado. Objetivo: Valorar clínica, citológica y radiográficamente una lesión osteomucosa tratada con membrana de quitosano. Presentación del caso: Paciente femenina de 18 años, sistémicamente sana a la que se le realizó una cirugía de los terceros molares inferiores retenidos. Para la ROG se hidrató una membrana de quitosano en solución fisiológica, y se cubrió el alveólo derecho con ella. A los 8 días se retiró la sutura y se realizó citología exfoliativa de ambas zonas. Se tomaron fotografías a los 15 días y al mes. También se realizaron radiografías panorámicas, a los 15 días, mes y a los 7 meses postquirúrgicos. Resultados: A los 8 días se observó la zona izquierda con dehiscencia de la herida, empaquetamiento de alimentos, mientras que en el lado derecho, fue menor el grado de inflamación y eritema, mejor cicatrización y escaza acumulación de placa. Al mes la mucosa en el lado derecho presentó óptimos signos de cicatrización, mientras que en izquierdo persistió acumulación de placa bacteriana. Radiográficamente, a los 15 días, en el lado derecho se observó continuidad de la zona intervenida con el hueso circundante y escaza aposición mineral. Al mes la densidad mineral fue Moderada (50 y 80 % del defecto). A los 7 meses postoperatorios la aposición mineral fue Abundante (mayor al 80 %). La citología Clase I Papanicolau del lado derecho evidenció porciones aisladas de la membrana de quitosano desprendidas, escasos elementos epiteliales aislados, sin evidencia de componentes inflamatorios. Conclusión: Los resultados obtenidos indican que el alveólo tratado con quitosano regeneró más rápido y el proceso inflamatorio fue menos agresivo que en el lado no tratado. Palabras Claves: Regeneración ósea, membranas, quitosano. BONE AND TISSUE REGENERATION WITH CHITOSAN MEMBRANE: A CASE REPORT. ABSTRACT
Guided bone and mucous membrane regeneration (GBR) using membranes of chitosan, excludes gingival epithelial cells and connective healing, promoting regeneration through active and proper ordering of the regenerated tissue. Objective: To evaluate clinical, cytological and radiographic bone and mucous injury treated with chitosan membrane. Case presentation: Female patient 18 years old, which systemically healthy subjects underwent surgery retained mandibular third molars. For the GBR was hydrated chitosan membrane in saline, and covered her right socket. At 8 days, suture removal and cytology was performed in both areas. Photographs were taken at 15 days and a month. Panoramic radiographs were also performed at 15 days, months and 7 months postoperative. Results: After eight days left side was observed with wound dehiscence, food packaging, while on the right side was lower the degree of swelling and erythema, better healing and scarce accumulation of plaque. Mucosal month on the right side showed signs of healing optimal, while left plaque accumulation persisted. Radiographically, after 15 days, on the right side was observed continuity of the surgical site with the surrounding bone mineral apposition and scarce. A month mineral density was moderate (50 and 80% of default). At 7 months postoperatively was abundant mineral apposition (greater than 80%). The Pap smear Class I on the right side showed isolated portions of the chitosan membrane detached, few isolated epithelial elements, without evidence of inflammatory components. Conclusion: Our results indicate that the alveolus treated with chitosan regenerated faster and the inflammatory process was less aggressive than in the untreated side.
Keywords: bone regeneration, membranes, chitosan.
Introducción Los defectos óseos en los maxilares pueden ocurrir por diversas razones tumores, quistes, infecciones o sencillamente defectos en alvéolos post exodoncia que representan el grueso de los defectos más comunes. Es por ello que actualmente, es más frecuente la necesidad de acudir a las terapias regenerativas o colocar sustitutos óseos, como tratamiento previo a la colocación de un implante dental o la colocación de protésis.
Dependiendo del tamaño del defecto, la regeneración autóloga podrá ocurrir a integridad. Pero el reemplazo del defecto por tejido conectivo es una limitación común de la cicatrización de los defectos óseos en los maxilares, ya que interfiere provocando inestabilidad y limitaciones funcionales y anatómicas 1.
La regeneración ósea guiada (ROG) es una terapia que viene a resolver el problema planteado anteriormente, cuya finalidad es inducir la regeneración de defectos óseos o mantener el nivel óseo ya existente en zonas edéntulas. Se fundamenta en la utilización de sistemas barrera mediante membranas que aislan un determinado defecto óseo, excluyendo células provenientes del epitelio gingival y el tejido conectivo en el proceso de cicatrización 2. Estas membranas pueden ser reabsorbibles y no reabsorbibles, siendo las no reabsorbibles las que presentan mayores inconvenientes ya que tienen que ser retiradas tiempo después de la cirugía y es frecuente que se expongan e infecten3. La membrana que se use para esta terapia idealmente debe cumplir con los siguientes requisitos1: biocompatible, impermeable[1], debe mantener el espacio suficiente en el cual el tejido óseo neoformado pueda crecer y la regeneración pueda ocurrir. La membrana debe ser manejable y tener la capacidad de integración con los tejidos vecinos. Todos estos requisitos han sido difíciles de obtener con las membranas disponibles en el mercado, sin mencionar el alto costo que implican y la desventaja que tienen dichos biomateriales al no actuar como una verdadera barrera biológica. Por otro lado, y en relación a la oclusividad, la membrana además de actuar como barrera, la misma debería permitir un cierto grado de permeabilidad y presentar una superficie porosa, ya que esto propicia la adhesión celular y el intercambio de fluídos y de gases con el medio.
Es decir, la mayoría de las membranas disponibles en el mercado y comúnmente usadas para la regeneración tisular guiada (RTG) y ROG, actúan como un apósito pasivo impidiendo el intercambio con el medio ambiente; sólo protegen, aíslan y rellenan. Sin embargo, el quitosano es un biomaterial bioactivo, lo que significa que promueve la curación de las heridas por liberación de productos biológicos asociados a él (glucosamina, plasma rico en plaquetas entre otros), además el quitosano por si mismo se comporta como una de tales productos biológicos. 4.
Para compensar un poco las desventajas que acompañan el uso de los sistemas de barrera disponibles, se han desarrollado las membranas de quitosano (polímero natural compuesto por cadenas de N-acetilglucosamina). Estas cadenas son reabsorbibles, de origen natural u orgánico, ya que proceden de la desacetilación de la quitina (componente principal del caparazón de los crustáceos, paredes celulares de hongos y de insectos). El quitosano es biocompatible y biodegradable 5,6 (por la lisozima y otras enzimas proteolíticas). Ejerce una función antimicrobiana 7, cicatrizante de heridas 8, analgésico( ya que absorbe un ion protonado presente en el sitio del dolor y la quitina absorbe la bradikinina enzima importante en la producción de dolor)9, además posee un efecto hemostático 10, antiviral 11, antitumoral 12 e inmunoadyuvante 13, propiedades por las cuales el quitosano ha sido ampliamente utilizado en la ingeniería de tejido óseo. Además, en estudios realizados in vitro y ensayos preclínicos en animales, el quitosano ha demostrado que promueve el crecimiento óseo14.
La combinación de quitosano con factores de crecimiento presentes en el plasma de pacientes que van a ser tratados con la terapia de ROG, le proporciona al material la característica de convertirse en un Scaffold implantable (Andamio o matriz que funge como malla donde tiene lugar la adhesión y proliferación celular a medida que se biodegrada), promoviendo la formación de tejido nuevo 15, 16,17.
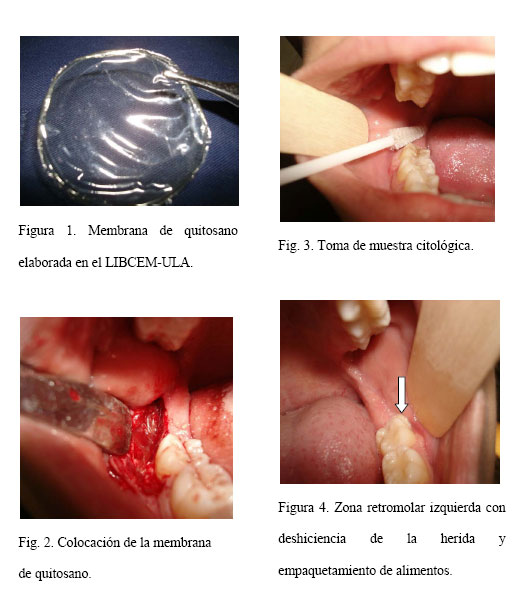
Las sales de quitosano, producto de la desacetilación termoalcalina de las conchas de camarón, han sido usadas con seguridad en seres humanos bajo la norma ASTM.F 2103-01[2], pero no así como biomaterial para la ROG en odontología. En tal sentido se planteó la utilización de biomembranas para tratar defectos óseos postquirúrgicos, las cuales fueron elaboradas en el Centro de Investigaciones Odontológicas de la Universidad de Los Andes (CIO-ULA) (ver figura 1), siguiendo el protocolo planteado por Velazco y cols.4. El presente caso clínico describe, la utilización y valoración de la respuesta osteomucosa posterior a la exodoncia de terceros molares incluídos.
Objetivo: Comparar la evolución clínica, histológica y radiográfica de una lesión osteomucosa tratada con Quitosano en contraste con una lesión tratada convencionalmente.
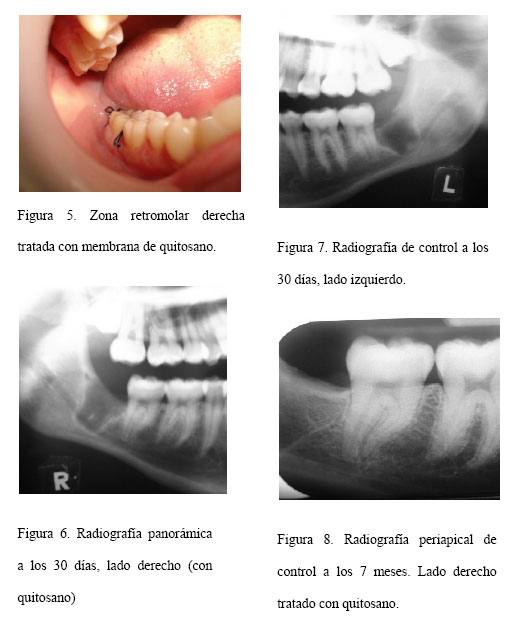
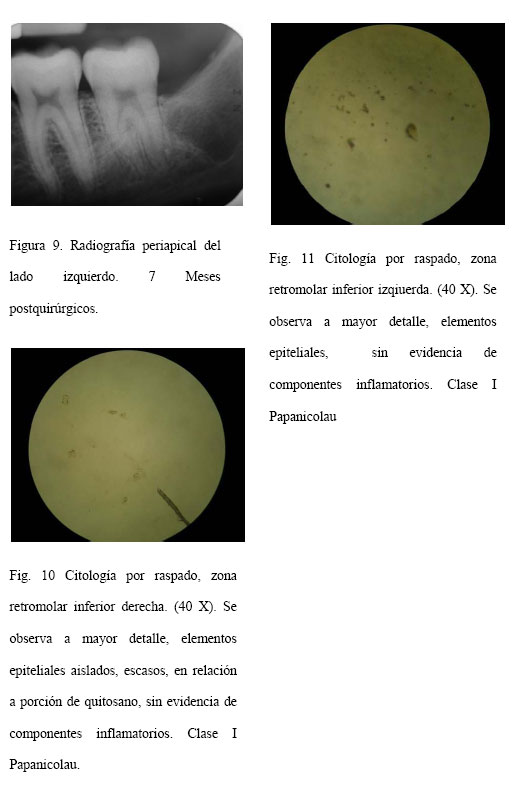
Presentación del caso Se trata de paciente femenina de 18 años de edad, quien acude a la consulta para extraerse los terceros molares inferiores, por motivos ortodónticos. Al interrogatorio, la paciente no manifestó antecedentes personales de enfermedades sistémicas. Al examen clínico, se observó gingivitis leve generalizada; restauraciones en buen estado en 36, 37; y apiñamiento dentario anterosuperior y anteroinferior, como hallazgos de importancia. Los exámenes de laboratorio complementarios arrojaron resultados estables y dentro de los valores normales para el acto quirúrgico. Al examen radiográfico, se observaron imágenes mixtas (radiolúcidas y radiopacas) en zona retromolar inferior y superior, compatibles con terceros molares retenidos. Previa a la intervención quirúrgica, la paciente firmó el consentimiento informado. La secuencia quirúrgica fue la siguiente: asepsia y antisepsia del campo operatorio con Clorhexidina al 0.12%, realización de la odontectomía bajo anestesia local troncular mandibular indirecta para el nervio dentario inferior e infiltrativa para el nervio bucal largo, con Lidocaína al 2%. Seguidamente, se efectuó una incisión de Winter modificada con alivio mesiovestibular en ambas zonas de la cirugía, con posterior levantamiento del colgajo mucoperióstico, osteotomía, localización de la pieza dentaria a extraer, odontosección y exodoncia propiamente dicha con elevadores. Seguidamente, se realizó la limpieza de la zona con solución fisiológica, hidratación de la membrana de quitosano de 2cm en solución fisiológica, colocación la misma cubriendo la zona alveolar remanente (figura 2), reposicionamiento del colgajo y sutura discontinua a puntos simples, empleando hilo de seda negra 3-0. Una vez culminado el procedimiento, se le dieron las indicaciones postoperatorias a la paciente y se le indicó tratamiento antibiótico y antiinflamatorio (Amoxicilina 500mg, 1 tableta cada 8 horas por 5 días; Ibuprofeno 400mg, 1 tableta cada 8 horas por 6 días). Se realizó el seguimiento clínico del caso con fotografías postoperatorias inmediatas, a los 15 días y al mes, evaluando cualitativamente los signos de inflamación y cicatrización de las zonas quirúrgicas. De igual forma, se realizaron controles con radiografías panorámicas, a los 15 días, al mes y a los 7 meses postquirúrgicos, verificando los siguientes criterios de regeneración ósea: Continuidad radiográfica de la zona intervenida con el hueso circundante: (0= No,1= Si) y Cantidad de la aposición mineral: (0=Densidad en la cavidad ósea que cubre menos del 50 % del defecto o Escasa ,1=Densidad en la cavidad ósea que cubre entre el 50 y 80 % del defecto o Moderada, 2=Densidad en la cavidad ósea que cubre más del 80 % del defecto o Abundante) Cabe destacar que a los 8 días postoperatorios se retiraron los puntos de sutura y se tomó una muestra por raspado con cepillo para citología (figura 3), en ambas zonas inferiores, con la finalidad de determinar la presencia o ausencia de cambios microscópicos en las células descamadas de la mucosa. Resultados En la valoración clínica, a los 8 días, se observó la mucosa del área correspondiente al tercer molar inferior izquierdo (área no tratada con la membrana) con dehiscencia de la herida, empaquetamiento de alimentos (figura 4). Por su parte, la mucosa del lado derecho (tratada con quitosano), presentó un menor grado de inflamación y eritema, mejor cicatrización y baja acumulación de placa bacteriana (Figura 5). Al mes postquirúrgico, el lado inferior tratado con quitosano, reveló una mucosa con óptimos signos de cicatrización, mientras que en el lado no tratado se observaron los bordes de la cicatriz irregulares además de acumulación de placa bacteriana . Respecto al control radiográfico, se presenta el siguiente cuadro resumen: Cuadro 1. Resultados de la evaluación del grado de regeneración ósea.
Fuente: Los autores. LEYENDA: Alvéolo tratado con Con Quitosano Alvéolo sin Quitosano Continuidad radiográfica de la zona intervenida con el hueso circundante: No = 0 Si = 1
Cantidad de la aposición mineral: 0= Escasa (menos del 50%), 1= Moderada (Entre 50 y 80%) 2= Abundante (más del 80 % del defecto) En el cuadro 1 se evidencia que en ambos lados existió continuidad radiográfica con el hueso circundante, pero la cantidad de la aposición mineral fue mayor y más rápida en la zona tratada con quitosano que en la izquierda. Al cabo de 1 mes en el defecto óseo tratado con quitosano (figura 6), se observó aposición mineral moderada (Entre el 50 y 80 % del defecto), mientras que en el defecto izquierdo la densidad ósea cubría menos del 50% del área (figura 7). A los 7 meses la densidad ósea era abundante en el defecto con quitosano (figura 8) y en el defecto izquierdo moderada.(figura 9) En lo concerniente a los resultados de la citología exfoliativa (papanicolau), en la zona tratada con quitosano se observó una citología Clase I, con evidencia de mínimos rastros aislados de la membrana de quitosano desprendidas (en la mucosa derecha), escasos elementos epiteliales aislados, sin evidencia de componentes inflamatorios (Figura 10). Mientras que en el lado no tratado se observó una mayor cantidad de elementos epiteliales, compatibles con un proceso inflamatorio (Figura 11). Discusión A pesar que en el examen citológico no se observaron diferencias importantes entre ambos defectos. Para el momento de la toma de la muestra clínicamente el lado izquierdo se observó más inflamado que el lado tratado con quitosano, el cual mostró una mejor cicatrización de la herida. En el momento de colocación de la membrana, se pudo evidenciar una mejor respuesta hemostática de la herida alveolar. Este efecto hemostático ya ha sido descrito debido a una interacción entre la membrana celular de los eritrocitos y el quitosano, siendo esta interacción independiente de la cascada clásica de la coagulación 12. La disminución de la inflamación y mejoría superior del lado tratado con quitosano puede atribuirse, por un lado a su capacidad de responder a un cambio de pH de ligeramente ácido a pH fisiológico18, y por el otro, y al actuar como un policatión, se une con mayor facilidad a las células y en particular al imidazol el cual inhibe a la tromboxano sintetasa, actuando como buffer, antioxidante y facilitando el proceso de cicatrización de los tejidos. Los parámetros radiográficos para verificar la regeneración ósea, indicaron que el defecto tratado con quitosano fue mayor y más rápida la remineralización, por lo cual se confirma el efecto osteogénico y osteoinductor que se le ha adjudicado al quitosano19. La respuesta ósea observada en este caso clínico coincide con la observada en un experimento realizado en humanos, en el cual se demostró que las membranas de quitosano con tecnología de nanofibra podían incrementar la regeneración ósea sin presentar ningún signo de reacción inflamatoria 14. Así mismo coincide con los resultados observados en investigaciones realizadas sobre animales de laboratorio20. El incremento de la regeneración ósea puede deberse a la propiedad osteoconductora del quitosano, el cual estimula la síntesis de colágeno tipo I, facilitando la diferenciación de células osteogénicas.20.
Al igual que en este caso clínico, otras investigaciones confirman que la membrana de quitosano es biocompatible al incrementar la regeneración ósea y no generar reacciones inflamatorias adversas 14,5.
La biocompatibilidad de las membranas de quitosano también es explicada por su origen natural, ya que todos los biomateriales producidos a partir de materias primas que provienen de la naturaleza han demostrado mejorar la promoción de la curación a un ritmo más rápido y mayor compatibilidad con los seres humanos. Entonces, resulta sumamente importante para la biocompatibilidad y biodegradación que el biomaterial a implantar tenga una topografía de superficie porosa, que permita en principio la colonización celular y a medida que aumenta la proliferación celular desaparezca la matriz 21.
Finalmente, tanto los resultados del presente caso y de otros estudios, representan evidencias clínicas de que la regeneración tisular asistida por membranas de quitosano, puede consttituir una importante técnica en odontología, que abre la posibilidad de estudiar ampliamente sus aplicaciones, especialmente en cirugía bucal y periodoncia, como material para elaborar membranas periodontales, matrices para el trasporte de fármacos y liberación de factores de crecimiento, formación de compuestos con otros materiales y minerales para injertos y rellenos óseos, entre otros 5,22 .
Conclusiones El alveólo tratado con quitosano regeneró más rápido y el proceso inflamatorio fue menos agresivo que en el lado no tratado. Por tanto, la membrana de quitosano se pudiera considerar para ser colocada en defectos óseos postoperatorios entre otros, actuando como un andamio o scaffold para la ingeniería de tejidos in vivo .Se recomienda valorar la eficiencia de dicha membrana para la regeneración ósea mediante estudios prospectivos.
Referencias Bibliográficas
•1. De la Rosa GM y col. Regeneración ósea guiada de cara al año 2000. Revista ADM 2000; 57 (4): 147-153
•2. Massimo M, y cols. Vertical ridge augmentation using a membrane technique associated with osseointegrated implants. Int J Periodont Rest Dent 1994; 14: 497-511.
•3. Simion M, Baldoni M, Rossi P, Zaffe D. A comparative study of the effectiveness of e-PTFE membranes with and without early exposure during the healing period. Int J Periodontics Restorative Dent 1994; 14: 166-80.
•4. Velazco, G., Ortiz, R., González, A. Nuevas terapéuticas para regeneración ósea a base de hidroxiapatita y quitosano. Acta Microscópica. 2011; 20 (Supp. A): 1-4. Disponible en: http://actamicroscopica.ivic.gob.ve/V20_1_2011/CONVEMI%202010%20(Supp.%20A)/index.html
•5. Jorquera R., Jorquera O., Rivera S. Quitosano: un Material con Propiedades Regenerativas y su Aplicación Clínica. Rev Eur Odontoestomatol. 2008. Disponible en: http://www.redoe.com/ver.php?id=100&highlight=quitosano
•6. Carhuapoma, L. Bernabé, J. Santiago 2,3. Caracterizacion de hidrogeles de quitosano-alcoholpolivinilico obtenidos por radiación gamma. Rev. Iberoam. Polim. 6(4), (2005).
•7. Rosero, M. Estudio de los biomateriales para el desarrollo de endoprotesis. [tesis]. Ingeniería Mecánica y Mecatrónica. Universidad Nacional de Colombia; 2003: 101-102.
•8. Sanz J, Garcia J, Doblare M. On scaffold designing for bone regeneration: a computational multiscale approach. Acta Biomaterial. 2009; 5(9): 219-29.
•9. Seol YJ, Lee JY, Park YJ, Lee YM, Young-Ku, Rhyu IC, Lee SJ, Han SB, Chung CP. Chitosan sponges as tissue engineering scaffolds for bone formation. Biotechnol Lett 2004; 26: 1037-41.
•10. Shen E, Chou T, Gau C, Tu H, Chen Y. Releasing growth factors from activated human platelets after chitosan stimulation: a possible bio-material for platelet-rich plasma preparation. Clinical Oral Implants Research. 2006; 17(5): 572-578.
•11. Ishihara C., et al., Anti-viral activity of sulfated chitin derivatives against Friend murine leukaemia and herpes simplex type-1 viruses. Vaccine. 1993; 11(6): 670-674.
•12. Qin C, Du Y, Xiao L, Li Z, Gao X. Enzymic preparation of water-soluble chitosan and their antitumor activity. Int. J. Biol. Macromol. 2002; 31(1-3): 111-117.
•13. Marcinkiewicz J, Polewska A, Knapczyk J. Immunoadjuvant properties of chitosan. Arch. Immunol. 1991; 39(1-2): 127-132.
•14. Seung S, Park H, Chong C. Biological evaluation of chitosan nanofifer membrane for guided bone regeneration. J Periodontol. 2005; 7(6): 1778-1784
•15. Elisseeff M. Scaffolding in tissue engineering. LA: CRC Press Taylor & Francis Group; B. Baum, D. Mooney. The impact of tissue engineering on dentistry. J Am Dent Assoc.2006; 10 (31): 309-318.
•16. Shen E, Chou T, Gau C, Tu H, Chen Y. Releasing growth factors from activated human platelets after chitosan stimulation: a possible bio-material for platelet-rich plasma preparation. Clinical Oral Implants Research. 2006; 17(5): 572-578.
•17. Hua Y., Ning C., Xiaoying L., Buzhong Z., Wei C., Xiaoling S. Natural hydroxyapatite/chitosan composite for bone substitute materials. Engineering in Medicine and Biology Society. 2006; 4(8): 88-91.
•18. Zhang Y, Ni M, Zhang M, Ratner B. Calcium phosphatechitosan composite scaffolds for bone tissue engineering. Tissue Eng. 2003; 9: 337-45.
•19. Lee JY, Nam SH, Im SY, Park YJ, Lee YM, Seol YJ, Chung CP, Lee SJ. Enhanced bone formation by controlled growth factor delivery from chitosan-based biomaterials. J Control Release 2002; 78:187-97.
•20. Eun P, Jeong P. Effects of chitosan on human periodontal fibroblasts in vitro and on bone formation in rat calvarial defects. J. Periodontol. 2005; 7(6): 526-533.
•21. Du, C. Apatite/amelogenin coating on titanium promotes osteogenic gene expression. J Dent Res. 2005; 8(4): 1070-1074.
[1] Es la propiedad oclusiva para prevenir que el tejido conectivo fibroso no entre al espacio cubierto por la membrana, al mismo tiempo que proteja a la herida contra una invasión bacteriana.[2] Las normas de la American Section of the international Association for testing materials (ASTM) constituyen una guía mundial para la estandarización en el uso de materiales y métodos para todas las industrias. |
|||||||||||||||||||||||||
Publicado el: 28/04/2011 18:33:39 |
|||||||||||||||||||||||||